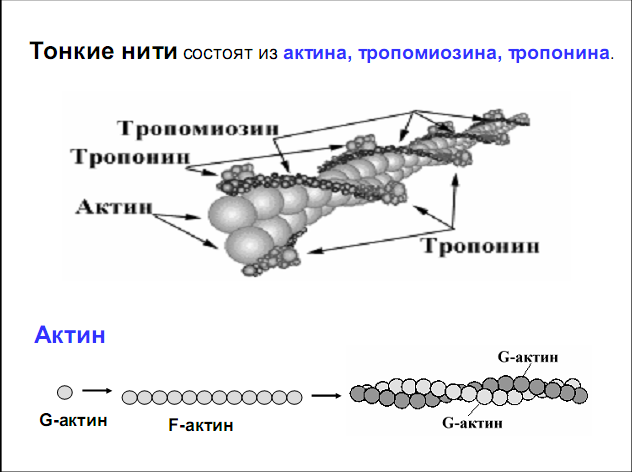
Структура белков четвертичной структуры, особенности синтеза и генетики
Содержание:
- Вторичная структура белка
- Четвертичная структура
- Свойства белка
- История
- Вторичная структура РНК
- Третичная структура
- Третичная структура
- Вторичная структура белка
- Альфа-спираль вторичной структуры
- Белок третичные проекты структуры
- Гемоглобин
- Водородная связь
- Белок четвертичной структуры
- Третичная структура белка[править | править код]
- Где образуется четвертичная структура молекулы белка?
- Бета-слой вторичной структуры
- Первичная структура белка
- Определение белка третичная структура
- Вторичная структура ДНК
- Предпосылки для изучения белковой структуры
- Образование вторичной белковой структуры
- Структурные компоненты белков
- Особенности вторичной структуры
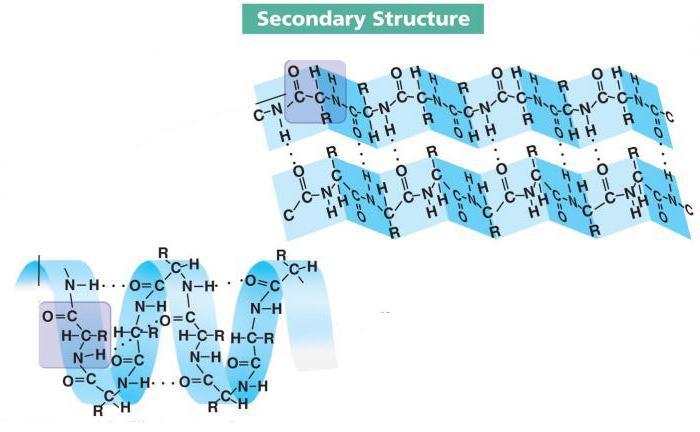
Вторичная структура белка
Образование пептидных связей – это первый этап созревания большинства белков. Чтобы они могли выполнять свои функции, их локальная конформация должна претерпеть некоторые изменения. Достигается это с помощью водородных связей – непрочных, но в то же время многочисленных соединений между основным и кислотным центрами молекул аминокислот.
Так формируется вторичная структура белка, от четвертичной отличающаяся простотой комплектации и локальной конформацией. Последнее означает, что не вся цепь подвергается преобразованию. Водородные связи могут образовываться на нескольких участках разной отдаленности друг от друга, причем их форма также зависит от типа аминокислот и способа комплектации.
Лизоцим и пепсин – это представители белков, имеющих вторичную структуру. Пепсин участвует в процессах пищеварения, а лизоцим выполняет защитную функцию в организме, разрушая клеточные стенки бактерий.
Четвертичная структура
Четвертичная структура характерна только для белков, состоящих из 2-х и более полипептидных цепей, которые определенным образом ориентированы друг относительно друга в пространстве и связаны слабыми ионными связями. Например, белковая часть гемоглобина состоит из 4 полипептидных цепей и функционально они могут быть активны только при их объединении. В данном случае нативная конформация складывается на уровне четвертичной структуры.
Классифицируют белки в самом общем плане на 2 группы: простые белки — протеины и сложные белки — протеиды.
Протеины состоят только из аминокислот. Сюда относятся альбумины, глобулины, фибриноген, гистоны, протамины, коллаген, кератин.
Протеиды в своей молекуле содержат как белковую часть, так и небелковые компоненты. Небелковая часть молекулы протеида носит название простетической группы. В качестве простетических групп в белковой молекуле могут присутствовать различные органические и неорганические вещества: нуклеотиды, липиды, углеводы, металлы, витамины. Такие протеиды могут соответственно называться: нуклеопротеиды, липопротеиды, гликопротеиды, металлопротеиды и т. д.
Свойства белка
Белок четвертичной структуры, особенно глобулярный, может изменять свою структуру. Происходит этот процесс под воздействием различных факторов. Чаще всего ими являются высокая температура, концентрированные кислоты или тяжелые металлы.
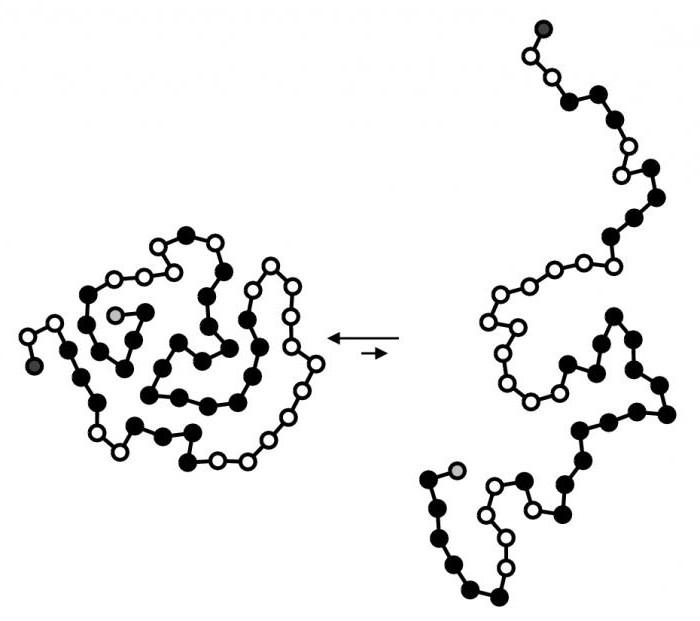
Если молекула белка раскручивается до цепи аминокислот, такое свойство называют денатурацией. Это процесс обратимый. Данная структура способна снова образовать глобулы молекул. Такой обратный процесс называют ренатурацией. Если же молекулы аминокислот отходят друг от друга и разрываются пептидные связи, происходит деструкция. Данный процесс необратим. Такой белок невозможно восстановить. Деструкцию осуществлял каждый из нас, когда жарил яичницу.
Таким образом, четвертичная структура белка — тип связи, который образуется в данной молекуле. Он достаточно прочен, но под воздействием определенных факторов способен разрушаться.
История
Наука о третичной структуре белков прогрессировала из одной из гипотезы к одному из подробного определения. Хотя Эмиль Фишер предположил, что белки были сделаны из полипептидных цепей и цепей стороны аминокислоты, именно Дороти Мод Ринч включила геометрию в предсказание структур белка. Ринч продемонстрировал это с моделью Cyclol, первым предсказанием структуры шаровидного белка. Современные методы в состоянии определить, без предсказания, третичных структур к в пределах 5 Å (0,5 нм) для маленьких белков (
Цитоплазматическая окружающая среда
Предсказание белка третичная структура полагается на знание основной структуры белка и сравнение возможной предсказанной третичной структуры с известными третичными структурами в банках данных белка
Это только принимает во внимание цитоплазматический подарок окружающей среды во время синтеза белка до такой степени, что подобная цитоплазматическая окружающая среда, возможно, также влияла на структуру белков, зарегистрированных в банке данных белка
Вторичная структура РНК
«Стебель-петля» — элемент вторичной структуры РНК, схематично
«Псевдоузел» — элемент вторичной структуры РНК, схематично
Дополнительные сведения: Предсказание вторичной структуры РНК
Молекулы РНК представляют собой единичные полинуклеотидные цепи. Отдельные участки молекулы РНК могут соединяться и образовывать двойные спирали. По своей структуре спирали РНК похожи на А-форму ДНК. Однако часто спаривание оснований в таких спиралях бывает неполным, а иногда даже и не уотсон-криковским. В результате внутримолекулярного спаривания оснований формируются такие вторичные структуры, как стебель-петля («шпилька») и псевдоузел.
Вторичные структуры в мРНК служат для регуляции трансляции. Например, вставка в белки необычных аминокислот, селенометионина и пирролизина, зависит от «шпильки», расположенной в 3′-нетранслируемой области. Псевдоузлы служат для программированного сдвига рамки считывания при трансляции.
В вирусных мРНК сложные вторичные структуры (IRES) направляют трансляцию, независящую от узнавания кэпа и факторов инициации трансляции (см. «»).
Третичная структура
А вот следующая структура — это клубок, в который закручивается спираль из аминокислот. Ее еще называют глобула. Существует она благодаря связям, возникающим между остатками только определенной аминокислоты — цистеина. Они называются дисульфидными. Эту структуру также поддерживают гидрофобные и электростатические связи. Первые представляют собой результат притяжения между аминокислотами в водной среде. В таких условиях их гидрофобные остатки практически «слипаются», образуя глобулу. Кроме того, радикалы аминокислот имеют противоположные заряды, которые притягиваются друг к другу. В результате возникают дополнительные электростатические связи.
Третичная структура
Дальнейшая упаковка белка приводит к формированию третичной структуры. Стабилизируется такая конформация с помощью водородных, дисульфидных, гидрофобных и ионных связей. Их большое количество позволяет скрутить вторичную структуру в более сложную форму и стабилизировать ее.
Разделяют глобулярные и фибриллярные белки. Молекула глобулярных пептидов представляет собой шаровидную структуру. Примеры: альбумин, глобулин, гистоны в третичной структуре.
Фибриллярные белки формируют прочные тяжи, длина которых превышает их ширину. Такие протеины чаще всего выполняют структурную и формообразующую функции. Примерами служат фиброин, кератин, коллаген, эластин.
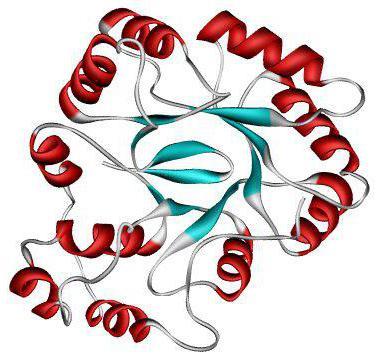
Вторичная структура белка
Альфа-спираль, состоящая из остатков аланина, вид сбоку. Водородные связи обозначены пурпурным цветом
Втори́чная структу́ра белка́ — пространственная структура, образующаяся в результате взаимодействия между функциональными группами пептидного остова.
Регулярные вторичные структуры
Регулярными называются вторичные структуры, образованные аминокислотными остатками с одинаковой конформацией главной цепи (углы φ и ψ), при разнообразии конформаций боковых групп.
К регулярным вторичным структурам относят:
- спирали, которые могут быть левозакрученными и правозакрученными с разным периодом и шагом. Большинство спиральных структур в полипептидных цепях поддерживается внутримолекулярными водородными связями. Водородная связь при этом образуется между карбонильной группой одного аминокислотного остатка и аминогруппой другого, лежащего ближе к N-концу полипептида. Разные типы спиралей описываются цифровой записью вида ab, где a — номер по цепи аминокислотного остатка, который предоставляет аминогруппу для формирования водородной связи, b — количество атомов в цикле, замкнутом водородной связью. К спиральным структурам, которые встречаются в белках, относятся:
- α-спираль, или спираль 413, — самая распространённая в белках вторичная структура. Данная спираль характеризуется плотными витками вокруг длинной оси молекулы, один виток составляет 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм (так что на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывают изгиб цепи и также нарушают α-спирали.
- 310-спираль — очень «тугая» спираль, в сечении имеет форму треугольника, в белках встречается в основном её правая форма, и то только в виде 1-2 витков.
- π-спираль, или спираль 516, — спираль с широкими витками, в результате в центре спирали остаётся пустое пространство. В белках встречается редко, обычно не более одного витка.
- β-листы (β-структура, складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Полипептидные цепи в составе β-листов могут быть направлены N-концами в противоположные стороны (антипараллельная β-структура), в одну сторону (параллельная β-структура), также возможно существование смешанной β-структуры (состоит из параллельной и антипараллельной β-структуры). Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин. β-структура является второй по частоте встречаемости в белках после α-спирали.
- полипролиновая спираль — плотная левая спираль, которая стабилизирована Ван-дер-Ваальсовыми взаимодействиями, а не системой водородных связей. Такая структура формируется в полипептидных цепях, богатых пролином, где формирование насыщенной системы водородных связей по этой причине невозможно. Полипролиновая спираль типа poly(Pro)II реализуется в коллагене, при этом три левых полипролиновых спирали перевиваются в правую суперспираль, которая стабилизируется водородными связями между отдельными цепями.
Нерегулярные вторичные структуры
Нерегулярными называют стандартные вторичные структуры, аминокислотные остатки которых имеют разную конформацию главной цепи (углы φ и ψ). К нерегулярным вторичным структурам относят:
- повороты — нерегулярные участки полипептидной цепи, которые обеспечивают поворот её направления на 180°. Если участок, обеспечивающий поворот, достаточно длинный, используется термин «петля». В 1968 году при описании поворотов из минимально возможного числа аминокислотных остатков (4) Венкатачалам ввёл для них термин «β-изгиб». Также существуют повороты из 4, 5 и 6 аминокислотных остатков.
- полуповороты, или переходы, — нерегулярные участки полипептидной цепи, которые обеспечивают поворот её направления на 90°. Минимальный полуповорот состоит из 3 аминокислотных остатков.
Альфа-спираль вторичной структуры
Поскольку в биосинтезе полипептидов участвуют только L-аминокислоты, то образование вторичной структуры белка начинается с закручивания спирали по часовой стрелке (правым ходом). На каждый спиральный виток приходится строго 3,6 остатков аминокислот, а расстояние вдоль спиральной оси составляет 0,54 нм. Это общие свойства для вторичной структуры белка, которые не зависят от вида аминокислот, участвовавших в синтезе.
Определено, что не вся полипептидная цепь спирализуется полностью. В ее структуре присутствуют линейные участки. В частности, молекула белка пепсина спирализована лишь на 30%, лизоцима — на 42%, а гемоглобина — на 75%. Это значит, что вторичная структура белка — это не строго спираль, а комбинирование ее участков с линейными или слоистыми.
Белок третичные проекты структуры
Алгоритм предсказания
Folding@home проект в Стэнфордском университете — распределенная вычислительная научно-исследовательская работа, которая использует приблизительно 5 petaFLOPS (~10 x86 petaFLOPS) доступного вычисления. Это стремится находить алгоритм, который будет последовательно предсказывать третичный белок и структуры четверки, данные последовательность аминокислот белка и ее клеточные условия.
Список программного обеспечения для белка третичное предсказание структуры может быть найден в
Болезни скопления белка
Болезни скопления белка, такие как болезнь Альцгеймера и Болезнь Хантингтона и прионные болезни, такие как коровья губчатая энцефалопатия могут быть лучше поняты, строя (и восстанавливая) модели болезни. Это сделано, вызвав болезнь у лабораторных животных, например, управляя токсином, таких как MPTP, чтобы вызвать болезнь Паркинсона, или через генетическую манипуляцию.
Предсказание структуры белка — новый способ создать модели болезни, которые могут избежать использования животных.
Гемоглобин
Четвертичная структура молекулы белка гемоглобина представляет собой 4 глобулы, соединенных межмолекулярными связями. В центре – порфин с ионом двухвалентного железа. Белок переносится в цитоплазме эритроцитов, где занимают около 80 % всего объема цитоплазмы.
Основой молекулы является гем, который имеет больше неорганическую природу и окрашен в красный цвет. Также это первичный продукт распада гемоглобина в печени.
Все мы знаем, что гемоглобин выполняет важную транспортную функцию – перенос кислорода и углекислого газа по организму человека. Сложная конформация молекулы белка формирует специальные активные центры, которые и способны связывать соответствующие газы с гемоглобином.
Когда образуется комплекс «белок-газ», формируются так называемые оксигемоглобин и карбогемоглобин. Однако есть еще одна разновидность таких объединений, которая достаточно устойчива: карбоксигемоглобин. Представляет собой комплекс из белка и угарного газа, устойчивость которого объясняет приступы удушья при чрезмерной токсикации.
Водородная связь
Вторичная структура белка — связь, основанная на множественных полярных взаимодействиях атомов с различными показателями электроотрицательности. Наибольшую способность к образованию такой связи имеют 4 элемента: фтор, кислород, азот и водород. В белках присутствуют все, кроме фтора. Потому водородная связь может образоваться и образуется, давая возможность соединять полипептидные цепи в бета-слои и в альфа-спирали.
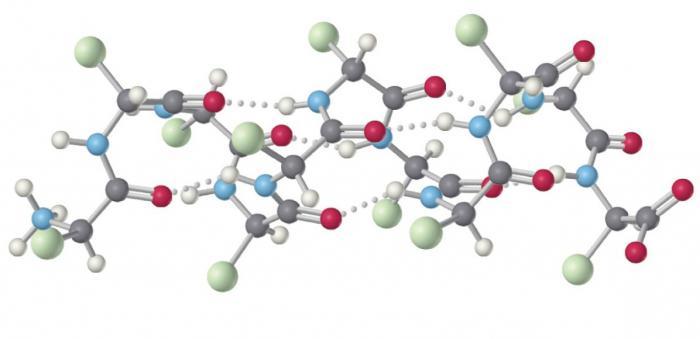
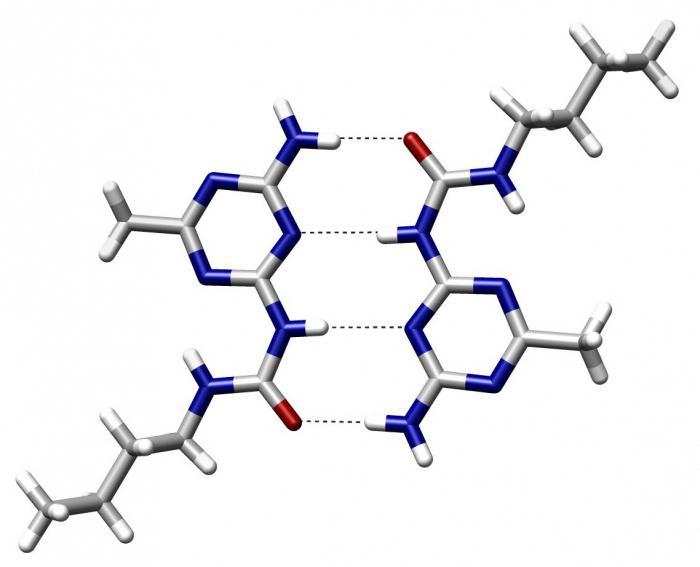
Наиболее легко объяснить возникновение водородной связи на примере воды, представляющей собой диполь. Кислород несет сильный отрицательный заряд, а из-за высокой поляризации О-Н связи водород считается положительным. В таком состоянии молекулы присутствуют в некой среде. Причем многие из них соприкасаются и сталкиваются. Тогда кислород от первой молекулы воды притягивает водород от другой. И так по цепочке.
Аналогичные процессы протекают и в белках: электроотрицательный кислород пептидной связи притягивает к себе водород из любого участка другого аминокислотного остатка, образуя водородную связь. Это слабое полярное сопряжение, для разрыва которого требуется потратить порядка 6,3 кДж энергии.
Для сравнения, самая слабая ковалентная связь в белках требует 84 кДж энергии для того, чтобы ее разорвать. Самая сильная ковалентная связь потребует 8400 кДж. Однако количество водородных связей в молекуле белка настолько огромно, что их суммарная энергия позволяет молекуле существовать в агрессивных условиях и сохранять свое пространственное строение. Благодаря этому существуют белки. Структура белков данного типа обеспечивает прочность, которая нужна для функционирования мышц, костей и связок. Настолько огромно значение вторичной структуры белков для организма.
Белок четвертичной структуры
Четвертичная структура белка является самой сложной. Это результат слияния нескольких глобул. Они могут различаться и по химическому составу, и по особенностям пространственной организации. Если белок четвертичной структуры образован только из остатков аминокислот, он является простым. Такие биополимеры еще называют протеинами. А вот в случае, если к данным молекулам присоединяются небелковые компоненты, возникают протеиды. Чаще всего это соединение аминокислот с углеводами, нуклеиновыми и фосфорными кислотными остатками, липидами, отдельными атомами железа и меди. В природе также известны комплексы белков с естественными красящими веществами — пигментами. Такое строение белковых молекул более сложное.
Пространственная форма четвертичной структуры белка является определяющей для его свойств. Учеными установлено, что нитевидные или фибриллярные биополимеры не растворяются в воде. Они выполняют важнейшие функции для живых организмов. Так, мышечные белки актин и миозин обеспечивают движение, а кератин является основой волосяного покрова человека и животных. Шаровидные или глобулярные белки четвертичной структуры хорошо растворимы в воде. Их роль в природе иная. Такие вещества способны транспортировать газы, как гемоглобин крови, расщеплять пищу, как пепсин, или осуществлять защитную функцию, подобно антителам.
Третичная структура белка[править | править код]
Третичная структура белка — это взаимное расположение в пространстве β-цепей, β-складчатых слоев и а-спиралей. Примеры различных способов укладки — мономеры креатинкиназы КК-М и КК-В (рис. 8.1).
Рис. 8.1. Третичная структура. β-Складчатые слои и а-спирали сворачиваются в пространстве с образованием двух разных мономеров креатинкиназы (КК-М и КК-В)
Четвертичная структура белкаправить | править код
Многие белки состоят из нескольких полипептидных цепей, которые связаны нековалентными связями. Мономером называется один отдельный белок, состоящий из одной полипептидной цепи. Когда мы говорим о четвертичной структуре белка, это означает, что в его состав входят несколько мономеров: 2 мономера образуют димер (рис. 8.2), три — тример, четыре — тетрамер и т.д. Олигомеры состоят из большого числа мономеров.
Рис. 8.2. Четвертичная структура. Два разных мономера креатинкиназы — КК-М и КК-В — связываются с образованием трех вариантов димеров. Это гомодимер КК-ММ (фермент скелетной мускулатуры), гомодимер КК-ВВ (фермент головного мозга) и гетеродимер КК-МВ (характерен для ткани сердечной мышцы)
Коллагенправить | править код
При кипячении соединительная ткань превращается в желатин, который можно использовать как клей. Отсюда и возникло название «коллаген» (по-гречески «kola» значит «клей»). На настоящий момент известно 19 разных типов коллагена. Коллагены — структурные белки соединительной ткани, самые многочисленные белки человеческого организма. Коллагены по-разному распределены в организме: так, коллаген I типа содержится главным образом в связках, сухожилиях и коже, а коллаген II типа — в хрящевой ткани. Структурные единицы коллагена — а-спирали, которые скручиваются в тройную спираль. В первичной последовательности коллагена повторяется мотив -Гли-X-Y-. В этой последовательности X обычно представлен пролином. На месте Y чаще всего находится остаток пролина, гидроксилированный в витамин С-зависимой реакции: таким образом, Y представляет собой остаток гидроксипролина. В других случаях Y может быть представлен остатком гидроксилизина (рис 8.3). Глицин — необходимый компонент коллагена. Это самая маленькая аминокислота: ее радикал R представлен лишь одним атомом водорода. Пространство в тройной спирали ограничено, и другие, более крупные, молекулы аминокислот просто не могли бы там поместиться.
Рис. 8.3. Гидроксилирование остатков лизина при образовании коллагена
Биосинтез коллагенаправить | править код
Рис. 8.4. Биосинтез коллагена
Коллаген — нерастворимый гликопротеин внеклеточного матрикса. Каким же образом фибробласты — клетки, синтезирующие коллаген, образуют нерастворимый внеклеточный белок? Все дело в том, что синтез коллагена осуществляется в 2 стадии: внутриклеточной и внеклеточной (рис. 8.4).
На внутриклеточной стадии происходит синтез проколлагена
Сначала внутриклеточный белковый аппарат синтезирует полипептидные а-спирали (длиной примерно в 1000 аминокислот). Некоторые из остатков пролина и лизина гидроксилируются в ходе реакций, для которых необходим витамин С. Некоторые остатки гидроксилизина гликозилируются. Потом а-спирали объединяются, сплетаясь друг с другом, и образуют тройную спираль проколлагена, который является растворимым белком.
На внеклеточной стадии формируются коллагеновые волокна
Проколлаген секретируется клеткой во внеклеточную жидкость. Фермент проколлагенпептидаза удаляет глобулярные пропептиды с N- и С-концевых участков молекул проколлагена, и образуется нерастворимый тропколлаген. Молекулы тропоколлагена объединяются в микрофибриллы, причем они располагаются в шахматном порядке так, что каждая молекула тропоколлагена перекрывается с соседними на четверть своей длины. Наконец, в присутствии лизиноксидазы остатки лизина и гидроксилизина реагируют друг с другом, формируя поперечные связи, что придает микрофибрилле прочность на растяжение, и микрофибриллы объединяются в одно полимерное коллагеновое волокно.
Где образуется четвертичная структура молекулы белка?
Полипептидная цепь начинает синтезироваться на рибосомах клетки, однако дальнейшее созревание протеина происходит уже в других органеллах. Новообразованная молекула должна попасть в транспортную систему, которая состоит из ядерной мембраны, ЭПС, аппарата Гольджи и лизосом.
Усложнение пространственного строения белка происходит в эндоплазматической сети, где не только формируются различные виды связей (водородные, дисульфидные, гидрофобные, межмолекулярные, ионные), но и присоединяются кофермент и кофактор. Так образуется четвертичная структура белка.
Когда молекула полностью готова к работе, она попадает либо в цитоплазму клетки, либо в аппарат Гольджи. В последнем случае эти пептиды упаковываются в лизосомы и транспортируются к другим компартментам клетки.
Бета-слой вторичной структуры
Вторым типом структурной организации вещества является бета-слой, который представляет собой две и более нити полипептида, соединенные водородной связью. Последняя возникает между свободными CO NH2 группами. Таким образом соединяются, в основном, структурные (мышечные) белки.
Структура белков данного типа такова: одна нить полипептида с обозначением концевых участков А-В параллельно располагается вдоль другой. Единственный нюанс в том, что вторая молекула располагается антипараллельно и обозначается как В-А. Так образуется бета-слой, который может состоять из сколько угодно большого количества полипептидных цепочек, соединенных множественными водородными связями.
Первичная структура белка
Первичная структура белка представлена, собственно, полипептидной цепочкой
Причем, уже на этом уровне закладывается специфичность белковой молекулы, которая определяется составом, количеством и, что особенно важно, строго определенной последовательностью соединения отдельных аминокислот друг с другом. Достаточно заменить местоположение аминокислот в полипептиде и возникает качественно новый белок
В этом, в частности, заключается возможность существования всего известного многообразия белков, в построении которых участвуют всего лишь 20 незаменимых аминокислот. К настоящему времени расшифрована первичная структура около 1000 белков. Первым из них был инсулин, содержащий 51 аминокислотный остаток.
Определение белка третичная структура
Знание третичной структуры разрешимых шаровидных белков более продвинуто, чем тот из мембранных белков, потому что прежнего легче изучить с доступной технологией.
Кристаллография рентгена
Кристаллография рентгена — наиболее распространенный инструмент, используемый, чтобы определить структуру белка. Это обеспечивает высокое разрешение структуры, но это не дает информацию о конформационной гибкости белка.
NMR
Белок NMR дает сравнительно более низкое разрешение структуры белка. Это ограничено меньшими белками. Однако это может предоставить информацию о конформационных изменениях белка в решении.
Двойная интерферометрия поляризации
Двойная интерферометрия поляризации предоставляет дополнительную информацию о захваченных белках поверхности. Это помогает в определении структуры, и структура изменяется в течение долгого времени.
Вторичная структура ДНК

Разные формы ДНК: A, B и Z (слева направо)
Дополнительные сведения: ДНК
Наиболее распространённой формой вторичной структуры ДНК является . Эта структура образуется из двух взаимно антипараллельных полидезоксирибонуклеотидных цепей, закрученных относительно друг друга и общей оси в правую спираль. При этом азотистые основания обращены внутрь двойной спирали, а сахарофосфатный остов — наружу. Впервые эту структуру описали Джеймс Уотсон и Френсис Крик в 1953 году.
В формировании вторичной структуры ДНК участвуют следующие типы взаимодействий:
- водородные связи между комплементарными основаниями (две между аденином и тимином, три — между гуанином и цитозином);
- стэкинг-взаимодействия;
- электростатические взаимодействия;
- Ван-дер-Ваальсовы взаимодействия.
В зависимости от внешних условий параметры двойной спирали ДНК могут меняться, причём иногда существенно. Правоспиральные ДНК со случайной нуклеотидной последовательностью можно грубо разделить на два семейства — А и В, главное отличие между которыми — конформация дезоксирибозы. К В-семейству также относятся С- и D-формы ДНК. Нативная ДНК в клетке находится в В-форме. Важнейшие характеристики А- и В-форм ДНК приведены в таблице.
| Признак | А-форма | В-форма | Z-форма |
|---|---|---|---|
| Спираль | правая | правая | левая |
| Количество пар оснований на виток | 11 | 10 | 12 |
| Шаг спирали | 28,6 Å | 33,6 Å | 45 Å |
| Диаметр спирали | 23 Å | 20 Å | 18 Å |
| Угол между плоскостями оснований и осью спирали | 70° | 90° | 100° |
| Конформация гликозидной связи | анти | анти | анти (у пиримидина), син (у пурина) |
| Конформация дезоксирибозы | С3’-эндо | С2’-эндо | С2’-эндо (у пиримидина), С3’-эндо (у пурина) |
Необычная форма ДНК была открыта в 1979 году. Рентгеноструктурный анализ кристаллов, образованных гескануклеотидами вида d(CGCGCG), показал что такие ДНК существуют в виде левой двойной спирали. Ход сахарофосфатного остова такой ДНК можно описать зигзагообразной линией, поэтому этот вид ДНК было решено назвать Z-формой. Было показано, что ДНК с определённой последовательностью нуклеотидов может переходить из обычной В-формы в Z-форму в растворе высокой ионной силы и в присутствии гидрофобного растворителя. Необычность Z-формы ДНК проявляется в том, что повторяющейся структурной единицей являются две пары нуклеотидов, а не одна, как во всех других формах ДНК. Параметры Z-ДНК приведены в таблице выше.
Предпосылки для изучения белковой структуры
Среди методов изучения строения химических веществ особенную роль играет рентгеноструктурная кристаллография. Посредством нее можно получить информацию о последовательности атомов в молекулярных соединениях и об их пространственной организации. Попросту говоря, рентгеновский снимок можно сделать и для отдельной молекулы, что стало возможным в 30-е годы XX века.
Именно тогда исследователи обнаружили, что многие белки имеют не только линейную структуру, но и могут располагаться в спиралях, клубках и доменах. А в результате проведения массы научных экспериментов выяснилось, что вторичная структура белка — это конечная форма для структурных белков и промежуточная для ферментов и иммуноглобулинов. Это значит, что вещества, которая в конечном итоге имеют третичную или четвертичную структуру, на этапе своего «созревания» должны пройти и этап спиралеобразования, свойственный вторичной структуре.
Образование вторичной белковой структуры
Как только завершился синтез полипептида на рибосомах в шероховатой сети клеточной эндоплазмы, начинает образовываться вторичная структура белка. Сам полипептид представляет собой длинную молекулу, занимающую много места и неудобную для транспорта и выполнения заложенных функций. Потому с целью уменьшения ее размеров и придания ей особенных свойств развивается вторичная структура. Это происходит путем образования альфа-спиралей и бета-слоев. Таким образом получается белок вторичной структуры, который в дальнейшем либо превратится в третичную и четвертичную, либо будет использоваться в таком виде.
Структурные компоненты белков
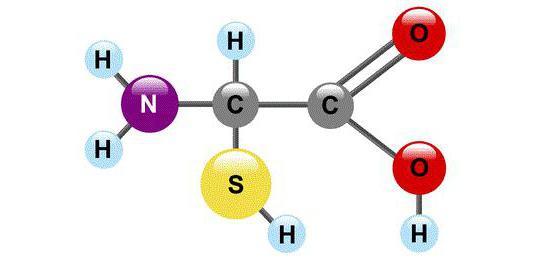
Мономерами любой полипептидной цепи являются аминокислоты (АК). Эти низкомолекулярные органические соединения достаточно распространены в природе и могут существовать как самостоятельные молекулы, выполняющие свойственные им функции. Среди них транспорт веществ, рецепция, ингибирование или активация ферментов.
Всего насчитывается около 200 биогенных аминокислот, однако только 20 из них могут быть мономерами белков. Они легко растворяются в воде, имеют кристаллическую структуру и многие из них сладкие на вкус.
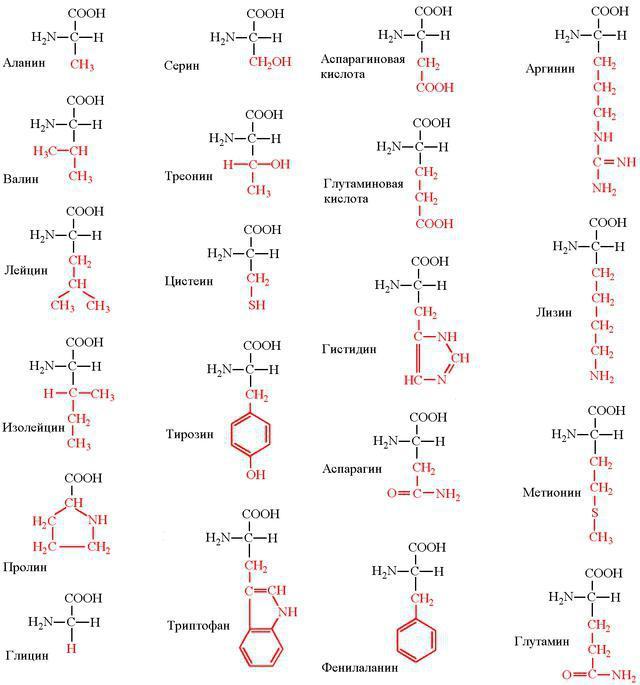
С химической точки зрения АК – это молекулы, в составе которых обязательно присутствуют две функциональные группы: -СООН и –NH2. С помощью этих групп аминокислоты образуют цепочки, соединяясь друг с другом пептидной связью.
Каждая из 20 протеиногенных аминокислот имеет свой радикал, в зависимости от которого разнятся химические свойства. По составу таких радикалов все АК классифицируются на несколько групп.
- Неполярные: изолейцин, глицин, лейцин, валин, пролин, аланин.
- Полярные и незаряженные: треонин, метионин, цистеин, серин, глутамин, аспарагин.
- Ароматические: тирозин, фенилаланин, триптофан.
- Полярные и заряженные отрицательно: глутамат, аспартат.
- Полярные и заряженные положительно: аргинин, гистидин, лизин.
Любой уровень организации структуры белка (первичный, вторичный, третичный, четвертичный) в основе имеет полипептидную цепь, состоящую из АК. Разница лишь в том, как эта последовательность складывается в пространстве и с помощью каких химических связей такая конформация поддерживается.
Особенности вторичной структуры
Локальные конформации пептидной цепи могут отличаться друг от друга. Их уже изучено несколько десятков, и три из них являются наиболее распространенными. Среди них альфа-спираль, бета-слои и бета-поворот.
Альфа-спираль – одна из часто встречающихся конформаций вторичной структуры большинства белков. Представляет собой жесткий стержневой каркас с ходом в 0,54 нм. Радикалы аминокислот направлены наружу.
Наиболее распространены правозакрученные спирали, и иногда можно найти левозакрученные аналоги. Формообразующую функцию выполняют водородные связи, которые стабилизируют завитки. Цепь, которая образует альфа-спираль, содержит очень мало пролина и полярных заряженных аминокислот.
- Бета-поворот выделяют в отдельную конформацию, хотя это можно назвать частью бета-слоя. Суть заключается в изгибе пептидной цепочки, который поддерживается водородными связями. Обычно само место изгиба состоит из 4-5 аминокислот, среди которых обязательно наличие пролина. Эта АК единственная имеет жесткий и короткий скелет, что позволяет образовать сам поворот.
- Бета-слой представляет собой цепочку аминокислот, которая образует несколько изгибов и стабилизирует их водородными связями. Такая конформация очень напоминает сложенный в гармошку лист бумаги. Чаще всего такую форму имеют агрессивные белки, однако встречается немало исключений.
Различают параллельный и антипараллельный бета-слой. В первом случае С- и N- концы в местах изгиба и на концах цепи совпадают, а во втором случае нет.