Бикарбонаты (бикарбонатная буферная система)
Содержание:
- Кто-нибудь вылечился от рака этим средством?
- Наука и исцеление рака бикарбонатом натрия
- Респираторные (дыхательные) кислотно-основные патологии[править | править код]
- Что произошло
- Ацидоз и алкалоз[править | править код]
- Классификация
- Названия популярных марок
- структура
- Химические свойства
- Бикарбонат натрия инструкция по применению
- Качественные реакции органических веществ
- риски
- Применение
- Получение
- Способы лечения раковой опухоли бикарбонатом натрия
- Основы физики
- Свойства
- Взаимосвязь между кислотностью организма и здоровьем
Кто-нибудь вылечился от рака этим средством?
На сегодняшний день тема, посвящённая целебным возможностям соды в вопросе излечения онкологических заболеваний, весьма актуальна и волнительна. Основополагающие мысли и научные наблюдения, положенные в основу теории Тулио Симончини, разделяет немало исследователей. Кроме того, среди обычных людей также немало приверженцев лечения бикарбонатом натрия, которые руководствуются данной методикой и регулярно принимают содовый раствор внутрь с целью избавления от рака или же профилактики его возникновения. Существует множество отзывов, которые касаются эффективности такого лечения, среди них можно встретить абсолютно разные точки зрения, однако стоит заметить, что в общей массе комментариев, посвящённых приёму соды для поддержания иммунитета или избавления от различных патологий, всё же преобладают положительные мнения.
К сожалению, конкретные имена больных, полностью излечившихся от рака или остановивших его развитие, неизвестны.
Наука и исцеление рака бикарбонатом натрия
Ученые давно знают о том, какие чудеса способен творить бикарбонат натрия. Лечение рака содой (точнее, его положительные результаты), оказывается, может быть подкреплено официальными научными исследованиями, выявившими быстрое прогрессирование роста опухолей в кислой среде при низком уровне кислородного питания клеток. Недавно в Китае были проведены научные эксперименты, позволившие сделать вывод, что кислая pH раковых клеток является главной причиной их устойчивости к лекарствам при проведении у больных химиотерапии.

На кафедре фармакологии университета в Аризоне целый ряд экспериментов позволил ученым сделать вывод, что подщелачивание организма бикарбонатом натрия может очень помогать при лечении такого грозного и распространенного заболевания, как рак молочной железы. Экспериментаторы установили, что ежедневный прием соды сдвигает pH в клетках опухоли в щелочную сторону и значительно понижает распространение и размножение раковых клеток в организме мышей. На основании проведенных опытов, ученые пришли к выводу, что исследования в этой области нужно обязательно проводить и дальше.
Респираторные (дыхательные) кислотно-основные патологии[править | править код]
Б. Респираторный ацидоз
Респираторный (дыхательный) алкалоз (Б) происходит в том случае, когда легкие удаляют больше СO2, чем образуется при метаболизме — гипервентиляция, что приводит к снижению РСO2 в плазме крови (гипокапния). И соответственно респираторный ацидоз происходит в том случае (Б), если удаляется меньше СОг, чем образуется, — гиповентиляция, что приводит к увеличению PCO2 в плазме (гиперкапния). Бикарбонатные и небикарбонатные (НББ-) буферные основания вместе компенсируют увеличение pH при метаболическом (нереспираторном) ацидозе, однако при респираторном алкалозе эти две буферные системы ведут себя различно (Б1). Система HCO3/СO2 в данном случае неэффективна, поскольку изменение РСO2 — причина, а не результат дыхательного алкалоза.
Респираторный (дыхательный) ацидоз может происходить при повреждении легочной ткани (например, при туберкулезе), при ухудшении альвеолярного газообмена (например, при отеке легких), при параличе дыхательных мышц (например, при полиомиелите), дыхательной недостаточности (например, при передозировке наркотиков), при недостаточной подвижности грудной клетки (например, в результате сильного искривления позвоночника), а также при других патологиях. В результате происходит увеличение концентрации СO2 в плазме ([СO2] = а • PCO2) и увеличение продукции HCO3 и Н+ (Б1, слева). Ионы Н+ связываются основаниями некарбонатных буферов (НББ- + Н+ ⇄ НББ-Н; Б1, справа), в то время как фактическая концентрация [HCO3]Act увеличивается. В отличие от нереспираторного ацидоза при респираторном ацидозе HCO3]St не изменяется (по крайней мере, в начале, так как этот показатель определен для нормы PCO2 и сохраняется неизменной, потому что снижение эквивалентно увеличению [HCO3]Act;. Поскольку относительное увеличение [HCO3]Act гораздо ниже, чем рост , отношение [HCO3]/[СO2] и pH ниже, чем в норме (ацидоз).
Если повышенное давление PCO2 поддерживается, происходит почечная компенсация (Б2) дыхательных нарушений. После латентного периода в 1-2 дня почки также начинают выводить избыточное количество ионов Н+ в составе титруемых кислот и NH4+. Каждый выведенный ион NH4+ приводит к связыванию одного иона HCO3 в печени, а каждый выведенный ион Н+ приводит к высвобождению канальцевыми клетками одного иона HCO3 в кровь. Этот процесс продолжается до тех пор, пока pH не достигнет нормы,
несмотря на увеличение PCO2. Часть ионов HCO3 используется для связывания Н+, высвобождаемых в реакции НББ-Н ⇄НББ- + Н+ (Б2, справа). По причине сравнительно длительного латентного периода почечной компенсации уменьшение pH более выражено при остром дыхательном ацидозе, чем при хроническом. При хронической форме ацидоза [HCO3] может возрастать примерно на 1 ммоль на каждые 1,34 кПа (10 мм рт. ст.) увеличения PCO2.
Респираторный (дыхательный) алкалоз обычно вызывается гипервентиляцией из-за тревоги (беспокойства) или в условиях высокогорья (дефицит кислородной вентиляции), что приводит к уменьшению PCO2 в плазме крови. Это ведет к небольшому снижению [HCO3 ]Act, поскольку некоторые ионы HCO3— превращаются в СO2 (HCO3 + Н+ ⇄ СO2 + Н2О); необходимые для этой реакции ионы HCO3 нейтрализуются ионами Н+ из НББ (нейтрализация: НББ-Н ⇄ НББ- + Н+). Это также является причиной для дополнительного снижения [HCO3-] при дыхательной компенсации нереспираторного ацидоза. Для адекватной нормализации pH (компенсации) требуется дальнейшее снижение [HCO3]Act. Это достигается при уменьшении выведения ионов Н+ почечными канальцами. В результате почки выводят повышенное количество ионов HCO3 (почечная компенсация).
При остром респираторном ацидозе или алкалозе СO2 диффундирует из крови в спинномозговую жидкость (СМЖ) быстрее, чем HCO3 и Н+. Низкая концентрация НББ при этом вызывает довольно сильные флуктуации значений pH спинномозговой жидкости, обеспечивая адекватную стимуляцию центральных хемосенсоров.
Что произошло
Что такое жёсткость воды?
Жёсткость воды – это величина, которая показывает, насколько много в ней содержится растворимых солей кальция и магния (а также железа!). При этом жёсткость воды делят на временную (устранимую) и постоянную. Временную обуславливают гидрокарбонаты кальция и магния (Ca(HCO3)2 и Mg(HCO3)2), а постоянную – их сульфаты (CaSO4 и MgSO4) и хлоридов (CaCl2 и MgCl2).
Таким образом, жёсткая вода – это вода, в которой одновременно содержится много солей кальция, магния и железа.
Зачем мы добавляем СаCl2?
Добавляя в воду раствор хлорида кальция CaCl2, мы искусственно увеличиваем её жёсткость. Как уже было сказано выше, CaCl2 обеспечивает постоянную (то есть не устранимую кипячением) жёсткость воды. Первая часть опыта нам наглядно это демонстрирует: при кипячении воды никаких видимых отложений на стенках не образуется.
Что происходит при добавлении NaHCO3?
При добавлении гидрокарбоната натрия NaHCO3 в растворе образуется гидрокарбонат кальция:
2NaHCO3 + СаCl2 Ca(HCO3)2 + 2NaCl
Именно за счёт образования Ca(HCO3)2 жёсткость нашей воды становится не постоянной, а временной – теперь её можно устранить кипячением.
Что происходит при нагревании воды?
Когда мы греем воду, растворимый гидрокарбонат кальция превращается в труднорастворимый карбонат:
Белёсый налёт на дне и стенках колбы – это и есть карбонат кальция.
Почему образуется накипь и как её устранить?
Накипь – это нерастворимый карбонат кальция CaCO3, выпавший в процессе термического разложения гидрокарбоната кальция Ca(HCO3)2:
И хотя толстый серый нарост совершенно не украшает посуду, в накипи нет ничего страшного. Напротив, она способна устранять излишнюю жёсткость водопроводной воды. К тому же от карбонатного налёта можно легко избавиться в домашних условиях. Например, чайники и кастрюли обычно чистят раствором лимонной кислоты С6H8O7:
3CaCO3 + 2С6H8O7 → Ca3(C6H5O7)2 + 3CO2 + 3H2O
Образующийся в результате цитрат кальция Ca3(C6H5O7)2 достаточно легко растворим в воде.
Узнать больше
Грязно-бежевый цвет накипи свидетельствует о наличии оксида железа Fe2O3. В водопроводной воде этот металл содержится в небольших количествах и присутствует в виде иона Fe2+, но при кипячении он выпадает в осадок.
Интересно, что накипь имеет тот же химический состав, что и природный камень известняк. Из этого минерала иногда состоят целые горы! Как правило, такие массивы славятся обилием пещер, так любимых спелеологами. Лёгкость образования пещер в известняке связана с тем, что даже слабокислые мягкие природные воды растворяют на своём пути карбонаты, образуя причудливые ходы в породе.
Также карбонат кальция является основой обычного мела, которым пишут на школьной доске и рисуют на асфальте. А ещё мел употребляется в качестве пищевой добавки – белого красителя E170.
Не стоит забывать, что карбонат кальция – то самое вещество, которое придает твёрдость яичной скорлупе. В наборе MEL Chemistry «Химия еды» есть эксперимент, в котором карбонат кальция растворяется с помощью столового уксуса (см. опыт «Резиновое яйцо»).
Как сделать воду мягче?
Воду, в которой содержится мало солей кальция и магния, называют мягкой, а процесс устранения жёсткости – умягчением.
Самым простым способом, наглядно демонстрируемым в нашем эксперименте, является кипячение. При нагревании гидрокарбонаты кальция (Ca(HCO3)2) и магния (Mg(HCO3)2) разлагаются:
Кипячение (термоумягчение) – самый древний способ умягчения воды для бытовых нужд. Конечно, таким способом можно устранить только временную (карбонатную) жёсткость. Постоянная жёсткость никуда не пропадает, и это наглядно демонстрируется в первой части нашего эксперимента: вода, обогащённая хлоридом кальция CaCl2, при кипячении не оставляет осадка.
С кипячением тесно связана дистилляция. В ходе этого процесса испарившаяся при нагревании жидкость снова собирается в капли (конденсируется) на охлаждённой поверхности. Подготовленная таким образом вода называется дистиллятом и совершенно не содержит ионов металлов. Из-за низкой минерализации дистиллированная вода не подходит для питья, т.к. способствует «вымыванию» минеральных веществ из организма. В то же время она широко используется в научной и промышленной сферах.
О более современных способах умягчения воды можно узнать в дополнении.
Ацидоз и алкалоз[править | править код]
Основная цель кислотно-основной регуляции — поддержание в норме pH крови и, таким образом, всего организма. Референтные (в норме) показатели кислотно-основного гомеостаза в плазме (артериализо-ванной капиллярной крови) указаны в таблице 2 и [HCO3]).
Референтные (в норме) кислотно-основные показатели плазмы крови
|
женщины |
мужчины |
|
|
(нмоль/л) |
39,8 ± 1,4 |
40,7 ±1,4 |
|
pH |
7,40 ± 0,015 |
7,39 ±0,015 |
|
РСO2, (кПа) |
5,07 ± 0,3 |
5,47 ± 0,3 |
|
[мм рт. ст.) |
38,9 ± 2,3 |
41,0 ±2,3 |
|
[HCO3] (ммол/л) |
24,0 ± 2,5 |
24,0 ±2,5 |
Кислотно-основный гомеостаз осуществляет сохранение баланса в нескольких процессах:
(Приток извне или образование ионов Н+) -(приток или образование ионов HCO3) = = (выведение ионов Н+) — (выведение ионов HCO3) = 60 ммоль/сут (зависит от диеты).
(Образование ионов CO2) = (выведение СO2) = 15 000-20 000 ммоль/сут.
Основными факторами, влияющими на первое равновесие, являются образование ионов Н+ (HCI, H2SO4, молочная кислота, Н3РО4 и т. д.) и их адекватное выведение почками. Вегетарианская диета может привести к значительному притоку ионов HCO3 (метаболизм: СO2 + ОН-⇄ HCO3). Чтобы компенсировать дополнительный приток извне, HCO3 выводится с мочой (следовательно, моча у вегетарианцев имеет тенденцию к защелачиванию).
Нарушения кислотно-основного баланса. Алкалоз наступает в том случае, если pH крови увеличивается выше нормы (см. таблицу), а ацидоз — при падении pH крови ниже наименьшего допустимого значения. Респираторные (дыхательные) кислотно-основные патологии наступают из-за первичных изменений PCO2, тогда как нереспираторные (метаболические)-из-за изменений [HCO3]. Кислотно-основные патологии могут быть частично или почти полностью компенсированы.
Классификация
Прежде, чем отправиться в магазин, надо ознакомиться с разнообразием щелочных вод и разобраться в их отличиях.
- По температуре: от очень холодной (ниже 4C) до высокотермальной (выше 42C).
- По назначению:
| Вид | Вместимость солей, г/л |
| Столовая | До 3 |
| Лечебно-столовая | 3-10 |
| Лечебная | Более 10 |
Среди всех вод 2 вида, выпускаемых в бутылках, гидрокарбонатные составляют приблизительно 30%. Они содержат много кислых солей угольной кислоты, до 15% хлоридов в виде поваренной соли.
По составу: гидрокарбонатно-натриевая(имеет содовый привкус) или со смешанным составом.
По показателю вместимости солей и назначению применения двууглекислые воды делят на:
- Слабощелочные: минерализация до 3 г/л. Разрешена к употреблению всем.
- Щелочные: минерализация 3-10 г/л. Рекомендуется непродолжительный курс приема.
- Сильнощелочные: минерализация 10-35 г/л. Принимаются только по рекомендации врача.
Обратите внимание! Важно учитывать, что при разных диагнозах дозировка, время применения и вид используемой воды различается
Названия популярных марок
Некоторые бренды минералки заслужили доверие покупателей и высокую репутацию благодаря качеству и оздоровительным свойствам воды. Их названия используют как символ здоровья и долголетия.
Слабощелочные
Список лучших столовых вод:
- «Буковинская» (минерализация до 1,2 г/л). Место происхождения – Украина. Сильно йодированная вода. Рекомендована при недостатке этого элемента.
- «Липецкая» хлоридно-сульфатная с натрием. Вблизи Липецка разливают 2 вида воды с минерализацией до 1,0 г/л: «Классическая», «Бювет 1». Воду надо употреблять непродолжительный период времени. При обострениях заболеваний стоит отказаться от питья минералки.
- «Архыз». Содержит натрий, магний, кальций (минерализация до 0,35 г/л). Добывается в Кавказских горах (Карачаево-Черкессия). Из-за слабой степени минерализации подходит для ежедневного приема, в качестве питьевой воды.

Щелочные
Столово-лечебные воды пользуются наибольшей популярностью, имеют более насыщенный состав. Они помогают вылечить различные недуги, но при этом у них относительно мягкий вкус.
Самые знаменитые марки:
-
«Боржоми». Одна из наиболее популярных вод (минерализация 5,5-7,5 г/л). На 90% состоит из НСО3-, остальные 10% составляют другие минеральные вещества:
- бор;
- фтор;
- магний;
- натрий;
- алюминий;
- кальций.
- «Нарзан» — сульфатно-гидрокарбонатная вода . Степень минерализации 2,0-3,5 г/л. Дополнительно содержит натрий и кальций. Месторождение – город Кисловодск.
- «Лужанская». Добывается в Закарпатье. Содержание НСО3- доходит до 100% (минерализация 3,6-4,3 г/л). Дополнительные микроэлементы: магний, фтор, кремний, калий, кальций.

Сильнощелочные
Сильнощелочные воды обладают выраженным лечебным эффектом, применяются только по назначению врача. Для них характерен яркий специфический вкус. Пить такую воду следует в строго ограниченном количестве.
Наиболее распространенными являются:
- «Ессентуки 17». Месторождение – город Ессентуки. Минерализация составляет 10-14 г/л. В высоких количествах содержатся следующие вещества: хлор, натрий, бор.
- «Поляна Квасова». Содержание гидрокарбонатных солей почти 100%, степень минерализации 6,5-12 г/л. Принимают ее до или после еды – в зависимости от требуемого эффекта и рекомендаций врача.
- Donat Mg. Источник находится в Словении, воду изготавливают по древним традициям и устраняют отрицательное воздействие внешней среды. Donat Mg улучшает работу пищеварительной системы. Большое количество магния снижает усталость.

структура
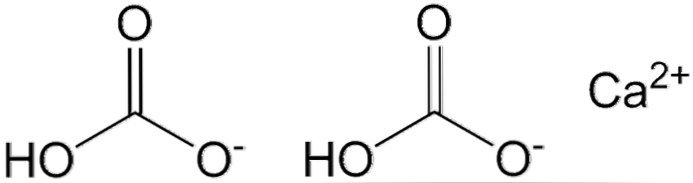
Два аниона HCO показаны на верхнем изображении3— и катион Ca2+ взаимодействуя электростатически. Ca2+ в соответствии с изображением, оно должно быть расположено посередине, поскольку именно так HCO3— они не будут отталкивать друг друга из-за своих отрицательных зарядов.
Отрицательный заряд в HCO3— он делокализован между двумя атомами кислорода путем резонанса между карбонильной группой C = O и связью C-O-; в то время как в СО32-, Это делокализовано между тремя атомами кислорода, так как связь С-ОН депротонирована и поэтому может получить отрицательный заряд по резонансу.
Геометрию этих ионов можно рассматривать как сферы кальция, окруженные плоскими треугольниками карбонатов с гидрированным концом. С точки зрения соотношения размеров, кальций заметно меньше, чем ионы HCO3-.
Водные растворы
Ca (HCO)3)2 Он не может образовывать кристаллические твердые вещества, и он действительно состоит из водных растворов этой соли. В них ионы не одни, как на изображении, а окружены молекулами H.2О.
Как они взаимодействуют? Каждый ион окружен сферой гидратации, которая будет зависеть от металла, полярности и структуры растворенных частиц.
Ca2+ координируется с атомами кислорода воды с образованием акокомплекса Ca (OH)2)N2+, где n обычно считается равным шести; то есть «водный октаэдр» вокруг кальция.
Пока HCO анионы3— взаимодействовать с водородными связями (ИЛИ2СО-Н-ОН2) или с атомами водорода в воде в направлении отрицательного заряда делокализует (HOCO)2— H-OH, диполь-ионное взаимодействие).
Эти взаимодействия между Ca2+, HCO3— и вода настолько эффективна, что они делают бикарбонат кальция очень растворимым в этом растворителе; в отличие от CaCO3, в котором электростатические притяжения между Ca2+ и СО32- очень сильны, выпадают в осадок из водного раствора.
Помимо воды, есть молекулы СО2 вокруг, которые реагируют медленно, чтобы обеспечить больше HCO3— (в зависимости от значения pH).
Гипотетическое твердое тело
Пока что размеры и заряды ионов в Са (HCO)3)2, ни присутствие воды, объясните, почему не существует твердого соединения; то есть чистые кристаллы, которые можно охарактеризовать с помощью рентгеновской кристаллографии. Ca (HCO)3)2 это не что иное, как присутствующие в воде ионы, из которых продолжают расти кавернозные образования.
Да ка2+ и HCO3— они могут быть изолированы от воды, избегая следующей химической реакции:
Ca (HCO)3)2(aq) → CaCO3(s) + CO2(г) + Н2O (l)
Затем их можно сгруппировать в белое кристаллическое твердое вещество со стехиометрическими пропорциями 2: 1 (2HCO3/ 1Ca). Там нет никаких исследований о его структуре, но это можно сравнить с NaHCO3 (для бикарбоната магния, Mg (HCO)3)2, не существует как твердое вещество), или с CaCO3.
Стабильность: NaHCO3 против Ca (HCO)3)2
NaHCO3 кристаллизуется в моноклинной системе, и СаСО3 в тригональной (кальцит) и ромбической (арагонитовой) системах. Если Na был заменен+ для ча2+, кристаллическая сеть будет дестабилизирована большей разницей в размерах; то есть Na+ поскольку он меньше, он образует более стабильный кристалл с HCO3— по сравнению с Ca2+.
На самом деле, Ca (HCO)3)2(aq) нуждается в воде, чтобы испариться так, чтобы ее ионы могли быть сгруппированы в кристалле; но кристаллическая решетка этого не достаточно сильна, чтобы сделать это при комнатной температуре. Когда вода нагревается, происходит реакция разложения (уравнение выше).
Быть ионом Na+ в растворе это будет кристалл с HCO3— до его термического разложения.
Причина, почему Ca (HCO)3)2 он не кристаллизуется (теоретически), это происходит из-за разницы ионных радиусов или размеров его ионов, которые не могут образовывать стабильный кристалл до его разложения.
Ca (HCO)3)2 против CaCO3
Если с другой стороны, H был добавлен+ к кристаллическим структурам CaCO3, они бы резко изменили свои физические свойства. Возможно, его точки плавления заметно падают, и даже морфология кристаллов в конечном итоге изменяется.
Стоит ли пытаться синтезировать Са (HCO)3)2 Твердая? Трудности могут превзойти ожидания, и соль с низкой структурной стабильностью может не дать существенных дополнительных преимуществ в любом применении, где другие соли уже используются..
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Проявляет все свойства соли сильного основания и слабой кислоты. В водных растворах имеет слабощелочную реакцию. В широком диапазоне концентраций в водном растворе pH раствора изменяется незначительно, на этом основано применение раствора вещества в качестве буферного раствора.
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами с образованием соли, соответствующей данной кислоте (например, с соляной кислотой — хлорида натрия, с серной — сульфата натрия), и угольной кислоты, которая в процессе реакции распадается на углекислый газ и воду, при этом углекислый газ выделяется в виде пузырьков:
- NaHCO3+HCl→NaCl+H2CO3,{\displaystyle {\mathsf {NaHCO_{3}+HCl\rightarrow NaCl+H_{2}CO_{3}}},}
- H2CO3→H2O+CO2↑,{\displaystyle {\mathsf {H_{2}CO_{3}\rightarrow H_{2}O+CO_{2}\uparrow }},}
- 2NaHCO3+H2SO4→Na2SO4+2H2O+2CO2↑.{\displaystyle {\mathsf {2NaHCO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2H_{2}O+2CO_{2}\uparrow }}.}
В быту обычно применяется реакция «гашения соды» уксусной кислотой, с образованием ацетата натрия или гашение лимонной кислотой с образованием цитрата натрия, реакция с уксусной кислотой:
- NaHCO3+CH3COOH→CH3COONa+H2O+CO2↑.{\displaystyle {\mathsf {NaHCO_{3}+CH_{3}COOH\rightarrow CH_{3}COONa+H_{2}O+CO_{2}\uparrow }}.}
Бикарбонат натрия инструкция по применению
Соду можно применять по-разному. Наверное, многие помнят, как в детские годы, когда мы заболевали простудой, мама или бабушка поили нас теплым молоком, в которое добавляли ложечку меда и немного соды. Болезнь начинала на удивление быстро отступать. Сегодня стоит воскресить из небытия этот древний способ лечения простудных заболеваний, ведь сода стоит совсем недорого, не то что некоторые новомодные лекарства, а действует, между тем, ничуть не хуже их. Размешать 1 ч. л. соды в стакане теплой воды и полоскать этим раствором горло при ангине — вот еще известный рецепт, где главным действующим ингредиентом является бикарбонат натрия.
Инструкция по применению соды для лечения рака может быть получена только у самого Симончини. А для профилактики этого заболевания можно добавлять немножко соды в различные напитки (чай, соки, морс). Только совсем немножко — на кончике ножа. Не пейте соду сразу после еды — это будет тормозить пищеварение. Идеальное время — между приемами пищи. Обязательно прочитайте о противопоказаниях и посоветуйтесь со своим врачом.
Качественные реакции органических веществ
|
Вещество, функциональная группа |
Реактив |
Схема реакции |
Характерные признаки |
|
Непредельные углеводороды (алкены, алкины, диены), кратные связи |
р-р KMnO4 (розовый) |
СН2=СН2 + Н2О + КMnO4 → КОН + MnO2↓+ СН2(ОН)-СН2(ОН) |
обесцвечивание р-ра |
|
р-р I2 (бурый) |
СН2=СН-CН3 + I2 → СН2(I)-СН(I)-CH3 |
обесцвечивание р-ра |
|
|
р-р Br2 (желтый) |
СН2=СН2 + Br2 → СН2(Br)-СН2(Br) |
обесцвечивание р-ра |
|
|
Ацетилен |
аммиачный р-р Ag2O |
образование осадка (ацетиленид серебра) белого цвета (взрывоопасен) |
|
|
Бензол |
нитрующая смесь HNO3 + H2SO4 |
tC, H2SO4(конц.) C6Н6 + HNO3 → C6H5-NO2 + H2O |
образование тяжелой жидкости светло-желтого цвета с запахом горького миндаля |
|
Толуол |
р-р KMnO4 (розовый) |
C6Н5-СН3 + KMnO4 + H2SO4 → C6Н5-COOH + H2O + K2SO4 + MnSO4 |
обесцвечивание р-ра |
|
Фенол (карболовая кислота) |
р-р FeCl3 (светло-желтый) |
C6Н5OH + FeCl3 → (C6Н5O)3Fe + HCl |
окрашивание р-ра в фиолетовый цвет |
|
насыщенный р-р Br2(бромная вода) |
C6Н5OH + 2Br2 → C6Н2Br3OH↓ + HBr |
образование белого осадка со специфическим запахом |
|
|
Анилин (аминобензол) |
р-р хлорной извести CaOCl2 (бесцветный) |
окрашивание р-ра в фиолетовый цвет |
|
|
Этанол |
насыщенный р-р I2 + р-р NaOH |
C2H5OH + I2 + NaOH → CHI3↓ + HCOONa + NaI + H2O |
образование мелкокристаллического осадка СНI3 светло-желтого цвета со специфическим запахом |
|
CuO (прокаленная медная проволока) |
C2H5OH + CuO → Cu↓ + CH3-CHO + H2O |
выделение металлической меди, специфический запах ацетальдегида |
|
|
Гидроксогруппа (спирты, фенол, гидроксикислоты) |
Металлический Na |
выделение пузырьков газа (Н2), образование бесцветной студенистой массы |
|
|
Эфиры (простые и сложные) |
Н2О (гидролиз) в присутствии NaOH при нагревании |
CH3-C(O)-O-C2H5 + H2O CH3COOH + C2H5OH |
специфический запах |
|
Многоатомные спирты, глюкоза |
Свежеосажденный гидроксид меди (II) в сильно щелочной среде |
ярко-синее окрашивание р-ра |
|
|
Карбонильная группа – СНО (альдегиды, глюкоза) |
Аммиачный р-р Ag2O |
образование блестящего налета Ag («серебряное зеркало») на стенках сосудов |
|
|
Свежеосажденный Сu(OH)2 |
R-CHO + Cu(OH)2 → R-COOH + Cu2O↓ + H2O |
образование красного осадка Сu2O |
|
|
Карбоновые кислоты |
лакмус |
окрашивание р-ра в розовый цвет |
|
|
р-р Na2CO3 |
выделение СО2 |
||
|
спирт +H2SO4(конц.) |
R-COOH + HO-R1 RC(O)OR1 + H2O |
специфический запах образующегося сложного эфира |
|
|
Муравьиная кислота |
Свежеосажденный Сu(OH)2 |
образование красного осадка Сu2O |
|
|
Аммиачный р-р Ag2O |
«серебряное зеркало» на стенках сосуда |
||
|
Олеиновая кислота |
р-р KMnO4 (розовый) или I2 (бурый) или Br2(желтый) |
C17H33COOH + KMnO4 + H2O → C8H17-CH(OH)-CH(OH)-(CH2)7-COOH + MnO2↓ + KOH C17H33COOH + I2 → C8H17-CH(I)-CH(I)-(CH2)7-COOH |
обесцвечивание р-ра |
|
Ацетаты (соли уксусной кислоты) |
р-р FeCl3 |
CH3COONa + FeCl3 → (CH3COO)3Fe + NaCl |
окрашивание р-ра в красно-бурый цвет |
|
Стеарат натрия (мыло) |
Н2О (гидролиз) + фенолфталеин |
C17H35COONa + H2O C17H35OOH↓ + NaOH |
окрашивание р-ра в малиновый цвет |
|
насыщенный р-р соли кальция |
C17H35COONa + Ca2+ (C17H35COO)2Ca↓ + Na+ |
образование серого осадка |
|
|
Концентрированная неорганическая кислота |
C17H35COONa + H+ C17H355COOH↓ + Na+ |
образование белого осадка |
|
|
Белок |
пламя |
реакция горения |
запах «паленого», жженых перьев |
|
НNO3 (конц.);t, °С |
ксантопротеиновая реакция (происходит нитрование бензольных колец в молекуле белка) |
|
|
|
Свежеосажденный Сu(OH)2 |
биуретовая реакция (образуется комплексное соединение) |
сине-фиолетовое окрашивание р-ра |
риски
Поскольку это соединение не существует в твердой форме, маловероятно, что оно будет представлять риск манипулирования его водными растворами, поскольку оба Са2+ как HCO3— они не вредны при низких концентрациях; и, следовательно, наибольший риск, который может возникнуть при приеме таких растворов, может быть связан только с употреблением опасной дозы кальция..
Если соединение образовало твердое вещество, хотя оно может физически отличаться от СаСО3, его токсические эффекты не могут выходить за рамки простого дискомфорта и резекции после физического контакта или вдыхания.
Применение
Данное вещество можно увидеть в составе газированных вод. Но соли угольной кислоты широко применяют:
- • для строительной сферы,
- • в процессе производства стекла,
- • в процессе производства моющих и чистящих средств,
- • производства бумаги,
- • для некоторых подкормок и удобрений для растений,
- • в медицине.
Отечественный и мировой рынок предлагает в продаже различные препараты и химические вещества, в состав которых входит угольная кислота:
- • мочевина или карбамид,
- • литиевая соль угольной кислоты,
- • углекислый кальций (мел),
- • кальцинированная сода (натрий углекислый) и т.д.
Карбамид используют в качестве удобрения для плодовых и декоративных растений. Его средняя цена составляет 30-40 рублей за 1 кг. Фасуют готовую продукцию в полиэтиленовые пакеты и мешки, весом 1, 5,25,50 кг.
Литиевую соль угольной кислоты используют в составе керамических изделий, ситаллов. Этот материал используется для производства камер сгорания для реактивных двигателей, его добавляют в глазури, эмали, грунтовки для различных металлов. Литиевую соль добавляют в грунтовки для обработки алюминия, чугуна и стали.
Это химическое вещество добавляют в процессе стекловарения. Стекла, в состав которых была добавлена литиевая соль, имеют повышенную проницаемость светлового потока. Иногда литиевую соль угольной кислоты используют в процессе производства пиротехники.
Получение
В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции:
- NH3+CO2+H2O→NH4HCO3{\displaystyle {\mathsf {NH_{3}+CO_{2}+H_{2}O\rightarrow NH_{4}HCO_{3}}}}
- NH4HCO3+NaCl→NaHCO3↓+NH4Cl.{\displaystyle {\mathsf {NH_{4}HCO_{3}+NaCl\rightarrow NaHCO_{3}\downarrow +NH_{4}Cl}}.}
В холодной воде гидрокарбонат натрия мало растворим, и его отделяют от охлаждённого раствора фильтрованием, а из полученного после фильтрования раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь:
- 2NH4Cl+Ca(OH)2→2NH3↑+CaCl2+2H2O.{\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow 2NH_{3}\uparrow +CaCl_{2}+2H_{2}O}}.}
Способы лечения раковой опухоли бикарбонатом натрия
Сегодня всё чаще и чаще можно встретить интересную информацию о том, что такое простое и доступное средство, как пищевая сода, способно излечить онкологическое заболевание или же предупредить его развитие. Может быть, кому-то подобные заявления покажутся нелепыми, однако данная теория всё же получила право на существование, она подпитывается научными исследованиями итальянского врача-онколога Тулио Симончини, который посвятил множество своих трудов разработке этой концепции и доказательству эффективности содотерапии в борьбе с раком.
Многолетние наблюдения доктора показывают, что поверхность новообразований большинства его пациентов оказывается покрытой грибком Кандида, который, как известно, развивается в закисленной среде и разрушается в щелочных условиях, создаваемых бикарбонатом натрия.
На основании сходного строения раковых клеток и кандид врач сделал предположение, что злокачественные опухоли можно также разрушать при помощи раствора соды, использовать который он предложил двумя основными способами:
- путём приёма бикарбоната натрия внутрь;
- методом внутривенного введения вещества.
Всемирного признания теория Симончини, конечно, не получила, однако сторонников его точки зрения среди учёных всё же немало. Кроме этого, некоторые страны, например, Китай, Япония и США, официально внедрили данную методику в свою медицину.
Рассмотрим более подробно существующие способы воздействия бикарбоната натрия на раковые клетки.
Основы физики
Показатель pH представляет собой отрицательный десятичный логарифм концентрации ионов водорода (H+). При показателе pH = 7,0 концентрация H+ составляет 10-7 или 1/107. При этом значении pH среда является нейтральной, поскольку концентрации OH- и H+ равны.
H2O → H+ + OH-
При pH = 1, концентрация H+ составляет 10-1 или 1/10, среда при этом является очень концентрированной кислотой.
pH 7,0 = нейтральная среда
pH > 7 = щелочная среда
pH < 7 = кислая среда
pH 7,4 = физиологическое значение pH внеклеточной жидкости (нормальные значения колеблются от 7,35 до 7,45)
В связи с особенностями логарифмического исчисления незначительные изменения pH соответствуют выраженным изменениям концентрации H+. При падении показателя с 7,4 до 7,0, кислотность среды (концентрация ионов водорода) повышается в 2,5 раза.
| pH | Концентрация H+ |
| 7,4 | 1/25.118.864 |
| 7,3 | 1/19.952.623 |
| 7,2 | 1/15.848.931 |
| 7,1 | 1/12.589.254 |
| 7,0 | 1/10.000.000 |
Обычно pH измеряют прямым методом при помощи специального стеклянного электрода, который имеет мембрану, проницаемую для H+.
Концентрация ионов бикарбоната — HCO3— измеряется бикарбонатным электродом или может быть получена расчетным путем.
CO2 обычно измеряется прямым методом при помощи СО2-электрода.
Существуют разнообразные физиологические буферные системы, которые помогают предотвратить внезапные скачки внутриклеточного значения pH (такие, как бикарбонатная, лактатная, фосфатная, аммонийная, гемоглобиновая, белковая и прочие). Бикарбонатная система участвует в регуляции pH всех компартментов внутренней среды, обладая возможностью вмешиваться в кислотно-щелочное состояние на двух уровнях: концентрация HCO3— регулируется почками, a CO2 — легкими.
H+ + HCO3— → H2CO3 → H2O + CO2
Точное значение pH среды может быть рассчитано при помощи уравнения Гендерсона-Хассельбаха:
pH = pK + log
/ = pK + log [HCO3-] / [H2CO3]
pK представляет собой специфичную для данного буфера константу (например, для бикарбонатной системы при 37°С pK составляет 6,1).
Поскольку концентрация HCO3— регулируется почками, а выведение CO2 — легкими, уравнение принимает следующий вид:
pH = константа ПОЧКИ / ЛЕГКИЕ
Свойства
Почти все карбонаты — бесцветные вещества. За исключением карбонатов щелочных металлов, они неустойчивы к нагреванию — разлагаются ещё до плавления. Карбонаты двухвалентных ртути и меди, а также многих трёхвалентных металлов не существуют при нормальных условиях.
Растворимость
Из средних карбонатов в воде растворимы только соли щелочных металлов, аммония и одновалентного таллия. Хуже всего растворимы карбонаты кальция, бария, стронция и свинца.
Все гидрокарбонаты, наоборот, хорошо растворимы в воде.
Как правило, карбонаты не образуют кристаллогидратов (исключение — карбонаты натрия и некоторых редких элементов).
Поскольку угольная кислота относится к слабым кислотам, растворы её солей вследствие гидролиза имеют щелочную реакцию, более сильную у карбонатов и более слабую у гидрокарбонатов.
Химические свойства
При нагревании гидрокарбонаты переходят в карбонаты:
- 2NaHCO3→100∘CNa2CO3+H2O+CO2{\displaystyle {\ce {2NaHCO3->Na2CO3{}+H2O{}+CO2}}}
При сильном нагревании (чем активнее металл, тем выше требуемая температура) все карбонаты разлагаются на оксиды и углекислый газ:
- Na2CO3→1000∘CNa2O+CO2{\displaystyle {\ce {Na2CO3->Na2O{}+CO2}}}
- CaCO3→800∘CCaO+CO2{\displaystyle {\ce {CaCO3->CaO{}+CO2}}}
Карбонаты реагируют с кислотами сильнее угольной (включая такие слабые, как уксусная) с выделением углекислого газа, эти реакции являются качественными реакциями на наличие карбонатов:
- Na2CO3+2HCl⟶2NaCl+H2O+CO2↑{\displaystyle {\ce {Na2CO3 + 2 HCl -> 2 NaCl + H2O + CO2 ^}}}
- NaHCO3+HCl⟶NaCl+H2O+CO2↑{\displaystyle {\ce {NaHCO3 + HCl -> NaCl + H2O + CO2 ^}}}
Под действием растворённого в воде углекислого газа нерастворимые карбонаты переходят в раствор, превращаясь в гидрокарбонаты (эти процессы протекают в природе и вызывают жёсткость воды):
- CaCO3+H2O+CO2⟶Ca(HCO3)2{\displaystyle {\ce {CaCO3 + H2O + CO2 -> Ca(HCO3)2}}}
- FeCO3+H2O+CO2⟶Fe(HCO3)2{\displaystyle {\ce {FeCO3 + H2O + CO2 -> Fe(HCO3)2}}}
Взаимосвязь между кислотностью организма и здоровьем
Прежде чем начать более подробно говорить про лечение бикарбонатом натрия раковых опухолей, мы хотим рассказать о важных обменных реакциях, протекающих в нашем организме. Все метаболические процессы зависят напрямую от такого критического фактора, как рН (кислотность) жидкостей организма и плазмы крови. Рассмотрим шкалу рН: чем выше эти показания, тем более закисленной является среда, в то же время более низкие значения сдвигают показатели в щелочную сторону.
Очень важно, чтобы в организме поддерживался здоровый гомеостаз (равновесие) рН в плазме — 7.4. Если человек здоров, показатели кислотности слюны должны варьироваться в диапазоне от 7.0 до 7.5
Колебания данных цифр могут зависеть от того, как индивид питается, от его физической активности, стрессов, выработки гормонов, сна и т. д.
Важно знать, что при сдвиге pH в кислую сторону создаются благоприятные условия для развития различных заболеваний, и напротив — ощелачивание организма способствует его оздоровлению