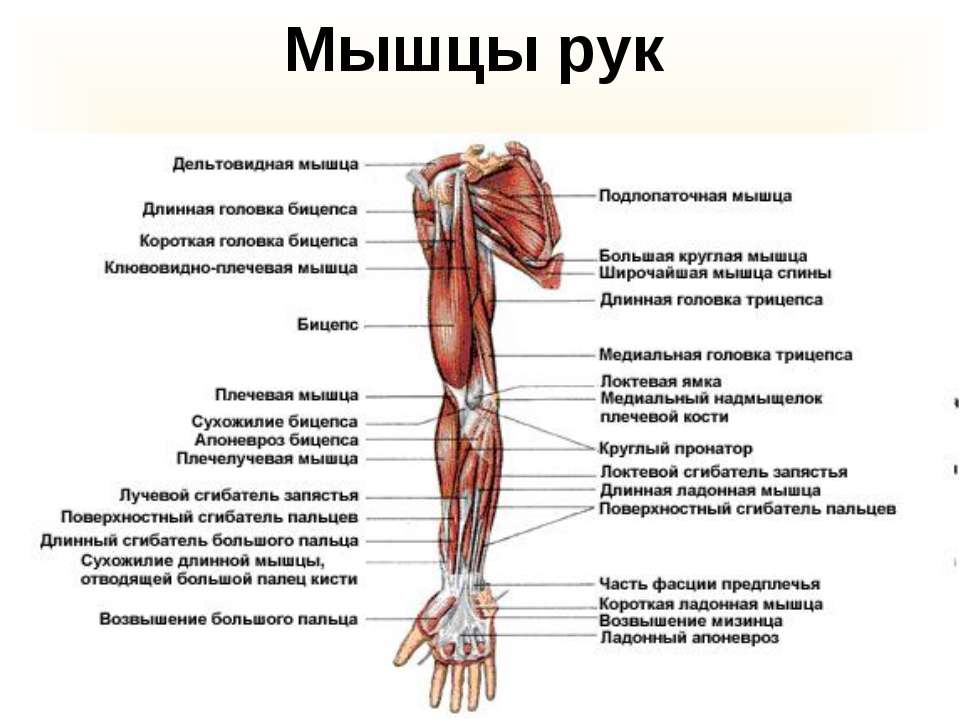
Физиология мышечного сокращения
Содержание:
Иннервация
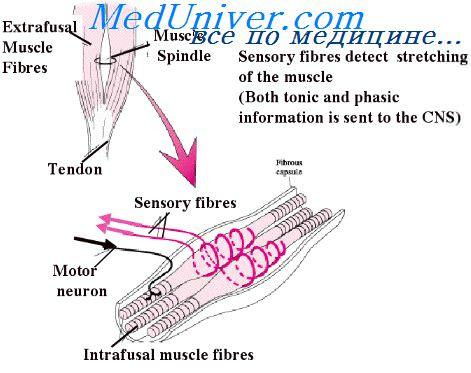
Этот процесс у поперечно-полосатых мышечных волокон реализуется посредством нервных волокон, а именно аксонов мотонейронов спинного мозга и головного ствола. Один мотонейрон иннервирует несколько волокон мышц. Комплекс с мотонейроном и иннервируемыми мышечными волокнами называют нейромоторной (НМЕ), или двигательной единицей (ДЕ). Среднее число волокон, которые иннервирует один мотонейрон, характеризует величину ДЕ мышцы, а обратную величину называют плотностью иннервации. Последняя является большой в тех мышцах, где движения небольшие и «тонкие» (глаза, пальцы, язык). Малое ее значение будет, напротив, в мышцах с «грубыми» движениями (например, туловище).
Иннервация может быть одиночной и множественной. В первом случае она реализуется компактными моторными окончаниями. Обычно это характерно для крупных мотонейронов. Мышечные волокна (называющиеся в этом случае физическими, или быстрыми) генерируют ПД (потенциалы действий), которые распространяются на них.
Множественная иннервация встречается, к примеру, во внешних глазных мышцах. Здесь не генерируется потенциал действия, так как в мембране нет электровозбудимых натриевых каналов. В них распространяется деполяризация по всему волокну из синаптических окончаний. Это необходимо для того, чтобы привести в действие механизм мышечного сокращения. Процесс здесь происходит не так быстро, как в первом случае. Поэтому его называют медленным.
Гладкие мышцы
Гладкие мышцы — это мышцы, формирующие слой стенок полых внутренних органов. Они построены из веретенообразных одноядерных мышечных клеток без поперечной исчерченности за счет хаотичного расположения миофибрилл.
Особенности гладких мышц:
- Иннервируются волокнами вегетативной нервной системы (ВНС);
- Обладают низкой возбудимостью:
- Обладают низкой величиной МП (мембранного потенциала) — -50 — -60 мВ из-за более высокой проницаемости для ионов Na+
- ПД (потенциал действия) отличается меньшей амплитудой и большей длительностью. Он формируется в основном за счет ионов Ca2+
- Медленная проводимость:
Клетки в гладких мышцах функционально связаны между собой посредством щелевидных контактов — нексусов, которые имеют низкое электрическое сопротивление. За счет этих контактов ПД распространяется с одного мышечного волокна на другое, охватывая большие мышечные пласты, и в реакцию вовлекается вся мышца.
Сократимость:
Гладкие мышцы способны осуществлять относительно медленные ритмические и длительные тонические сокращения.
Медленные ритмические сокращения обеспечивают перемещение содержимого органа из одной области в другую.
Длительные тонические сокращения, особенно сфинктеров полых органов, препятствуют выходу из них содержимого.
Пластичность:
Это способность сохранять приданную им при растяжении или деформации форму. Благодаря пластичности гладкая мышца может быть полностью расслаблена как в укороченном, так и в растянутом состоянии.
Автоматия:
Особенность гладких мышц, отличающая их от скелетных. Благодаря автоматии гладкие мышцы могут сокращаться в условиях отсутствия иннервации. Важную роль в этом играет растяжение.
Растяжение является адекватным раздражителем для гладкой мускулатуры. Сильное и резкое растяжение гладких мышц вызывает их сокращение.
Сравнительная характеристика скелетных и гладких мышц:

Roll and lock: поворачиваем и запираем
По гипотезе рычага, в мышечном сокращении существует только
один момент генерации силы — когда поворачивается миозиновый хвост
(рычаг). Однако некоторые данные рентгенографии и томографии мышц не то
чтобы не согласуются с этой теорией, а свидетельствуют о том,
что существует еще какой-то непонятный момент в сокращении мышцы,
который гипотеза рычага не объясняет. Поэтому группа исследователей под
руководством А. К. Цатуряна предложила теорию мышечного
сокращения под названием «Roll and lock» — «Поворачиваем и
запираем» (см.: Michael A. Ferenczi et al., 2005. The «Roll and Lock» Mechanism of Force Generation in Muscle).
По этой теории, миозиновые головки садятся на актин еще
до гидролиза АТФ, причем садятся не стройно и организованно, а как
попало. На головке миозина есть длинный выступающий домен —
«щуп», — который «нащупывает» подходящую себе (кислую и
отрицательно заряженную) часть актиновой нити и прилипает
к ней — как придется, под первым попавшимся углом. Однако
стоит произойти гидролизу АТФ, как миозин меняет свою конформацию,
головки поворачиваются под нужным углом и крепко и четко, как ключ
с замком, сцепляются с актиновой нитью, а из миозинового
кармана выбрасывается фосфат. И вот только после этого происходит
поворот рычага. Иными словами, модель получается двухстадийной — на
первом этапе головка миозина крепко и четко вцепляется в актин и
при этом немного поворачивается, а на втором — поворачивается
рычаг, причем сила, которая потом приведет к движению мышцы,
генерируется на обоих этих этапах.
Помимо рентгеноструктурных и томографических данных, которые очень
хорошо согласуются с теорией «Roll and lock», существует и
несколько косвенных, но очень красивых доказательств ее правоты.
Например, известно, что во время мышечного сокращения, в том
случае, если мышца не меняет свою длину, всего чуть более
40% миозиновых головок сидит на актине, а остальные болтаются
ни к чему не присоединенными. Однако когда сжатую мышцу насильно
растягивают (например, такое бывает при беге, когда человек
приземляется на напряженную мышцу), то жесткость мышцы резко
увеличивается из-за того, что почти все свободные миозиновые головки
резко сцепляются с актиновой нитью. Однако, судя
по рентгеноструктурным данным, сцепляются они отнюдь не «намертво»,
как ключ с замком, а просто как попало. Объяснить это можно как
раз с помощью теории «Roll and lock». Гидролиз АТФ при растяжении
мышцы прекращается (оно и понятно: какой смысл тратить АТФ, если работа
совершается не мышцей, а над мышцей), и все
миозиновые головки переходят в состояние «активного актинового
поиска» — их торчащий щуп ищет актиновую нить, нащупывает
на ней подходящее место и сцепляется с ним — не
крепко-накрепко, не как ключ с замком, а как попало. Однако
для того, чтобы увеличить жесткость мышцы (и этим защитить
кости от перелома) этого оказывается достаточно.
Механизм сокращения поперечно-полосатых мышц
Любая скелетная мышца состоит из мышечных волокон, которые, в свою очередь, состоят из множества тонких нитей — миофибрилл, расположенных продольно. Каждая миофибрилла состоит из протофибрилл — нитей сократительных белков: миозина (миозиновая протофибрилла), актина (актиновая протофибрилла).
Кроме сократительных белков в миофибрилле имеются два регуляторных белка: тропомиозин и тропонин.
Миозиновые волокна соединены в толстый пучок, от которого в торону актиновых нитей отходят поперечные мостики. У каждого мостика выделяют шейку и головку.
Нить актина располагается в виде 2 скрученных ниток бус. На ней имеются актиновые центры.

Тропомиозин в виде спиралей оплетает поверхность актина, закрывая в покое ее центры. Одна молекула тропомиозина контактирует с 7 молекулами актина.
Тропонин образует утолщение на конце каждой нити тропомиозина.
Под влиянием возникшего в мышечном волокне ПД из саркоплазматического ретикулума (СПР — депо Ca2+) высвобождаются ионы Ca. Кальций связывается с тропонином, который смещает тропомиозиновый стержень, что приводит к открытию актиновых центров.

В результате, к актиновым центрам присоединяются головки поперечных миозиновых мостиков.
Эти постики совершают «гребущие движения», в результате чего нити актина перемещаются этими мостиками относительно волокон миозина, происходит укорочение мышцы.
Процесс расслабления происходит в обратной последовательности с использованием энергии АТФ за счет функционирования кальциевого насоса.
При отсутствии повторного импульса ионы Ca не поступают из СПР. В результате отсутствия Ca-тропонинового комплекса, тропомиозин возвращается на свое прежнее место, блокируя актиновые центры актина. Актиновые протофибриллы легко скользят в обратном направлении благодаря эластичности мышцы, и мышца удлиняется (расслабляется).
Типы
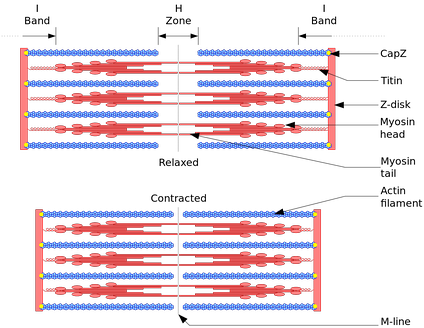 Схема, показывающая мышцы в расслабленном (выше) и сокращённом (ниже) положениях.
Схема, показывающая мышцы в расслабленном (выше) и сокращённом (ниже) положениях.
Основой всех типов мышечного сокращения служит взаимодействие актина и миозина. В скелетных мышцах за сокращение отвечают миофибриллы (примерно две трети сухого веса мышц). Миофибриллы — структуры толщиной 1-2 мкм, состоящие из саркомеров — структур длиной около 2,5 мкм, состоящих из актиновых и миозиновых (тонких и толстых) филаментов и Z-дисков, соединённых с актиновыми филаментами. Сокращение происходит при увеличении концентрации в цитоплазме ионов Ca2+ в результате скольжения миозиновых филаментов относительно актиновых. Источником энергии сокращения служит АТФ. КПД мышечной клетки около 50 %, мышцы в целом не более 20%. Максимальная сила мышц не достигается в реальных условиях; не все клетки мышцы используются одновременно и сокращаются с максимальной силой, иначе при сокращении многих скелетных мышц будут повреждены сухожилия или кости (что иногда и наблюдается при сильных судорогах). КПД мышцы также зависит от внешних условий; например, на холоде он значительно снижается, так как для организма важнее сохранить температуру тела.
Изометрическое сокращение
- Основная статья:
Изометрическое сокращение мышцы создаёт напряжение без изменения длины. Пример можно найти, когда мышцы руки и предплечья захватывают объект; суставы руки не двигаются, но мышцы генерируют достаточную силу, чтобы предотвратить падение объекта.
Изотоническое сокращение
- Основная статья:
При изотоническом сокращении напряжение в мышцах остаётся постоянным, несмотря на изменение длины мышц. Это происходит, когда сила сокращения мышц соответствует общей нагрузке на мышцы.
Концентрическое сокращение
При концентрическом сокращении мышечное напряжение является достаточным для преодоления нагрузки, а мышца укорачивается при сокращении. Это происходит, когда сила, создаваемая мышцей, превышает нагрузку, противодействующую её сокращению.
Эксцентрическое сокращение
- См. также:
При эксцентрическом сокращении напряжение недостаточно для преодоления внешней нагрузки на мышцы и мышечные волокна, удлиняются при их сокращении. Вместо того, чтобы тянуть сустав в направлении сокращения мышц, мышца действует так, чтобы замедлить сустав в конце движения или иным образом контролировать перемещение груза. Это может происходить невольно (например, при попытке переместить вес, слишком тяжёлый для подъёма мышцы) или добровольно (например, когда мышца «сглаживает» движение или сопротивляется гравитации, как, например, во время ходьбы вниз). В краткосрочной перспективе силовые тренировки с участием как эксцентрических, так и концентрических сокращений, по-видимому, увеличивают мышечную силу больше, чем тренировки только с концентрическими сокращениями. Однако вызванное физическими упражнениями повреждение мышц также больше при удлинении сокращений.
Эксцентрические сокращения в движении
Эксцентрические сокращения обычно возникают как тормозящее усилие в противоположность концентрическому сжатию, чтобы защитить суставы от повреждения. Во время практически любого обычного движения эксцентрические сокращения помогают сохранять плавность движений, но также могут замедлять быстрые движения, такие как удар или бросок. Часть тренировки для быстрых движений, таких как качки во время бейсбола, включает в себя уменьшение эксцентрического торможения, позволяющего развивать большую мощность во время движения.
ТЕОРИЯ МЫШЕЧНОГО СОКРАЩЕНИЯ
Основное явление при мышечном сокращении сводится к укорочению мышечного волокна. При этом натуральная длина волокна уменьшается и мышца совершает механическую работу. Как мы уже знаем, для сокращения мышца получает энергию при распаде АТФ. Само же сокращение происходит за счет укорочения молекулы мышечного белка—миозина (рис.). Волна возбуждения, поступившая в мышцу, вызывает в ее волокнах физические и химические изменения, в частности концентрация ионов калия внутри волокна уменьшается, а концентрация ионов кальция повышается — эти изменения и обусловливаются сокращением молекулы миозина. Миозин обладает еще одним свойством: он способствует образованию аденозинтрифосфорной кислоты.
Статья на тему Химические превращения в мышце
Саркомеры и филаменты
Саркомеры представляют собой сегменты волокон, которые отделяются так называемыми Z-пластинами, содержащими бета-актинин. От каждой пластины отходят актиновые филаменты, а промежутки заполняются толстыми миозиновыми аналогами. Актиновые элементы, в свою очередь, похожи на ниточки бус, закрученных в двойную спираль. В этой структуре каждая бусинка является молекулой актина, а в участках с углублениями в спирали находятся молекулы тропонина. Каждая из этих структурных единиц формирует механизм сокращения и расслабления мышечного волокна, связываясь друг с другом. Ключевую роль в возбуждении волокон играет клеточная мембрана. В ней заключены поперечные трубочки-инвагинации, которые активизируют функцию саркоплазматического ретикулума – это и будет возбуждающий эффект для мышечной ткани.
Источник энергии для сокращения
Для сокращения мышцы используется энергия гидролиза АТФ, но мышечная клетка имеет крайне эффективную систему регенерации запаса АТФ, так что в расслабленной и работающей мышце содержание АТФ примерно равно. Фермент фосфокреатинкиназа катализирует реакцию между АДФ и креатинфосфатом, продукты которой — АТФ и креатин. Креатинфосфат содержит больше запасённой энергии, чем АТФ. Благодаря этому механизму при вспышке активности в мышечной клетке падает содержание именно креатинфосфата, а количество универсального источника энергии — АТФ — не изменяется.
Механизмы регенерации запаса АТФ могут различаться в зависимости от парциального давления кислорода в окружающих тканях (см. Анаэробные организмы).
Разница между кинезином и миозином
Определение
Кинезин относится к АТФазе, сходной с динеином, которая функционирует в качестве моторного белка во внутриклеточном транспорте, особенно клеточных органелл и молекул (таких как митохондрии и белки) вдоль микротрубочек. Миозин относится к волокнистому белку, который образует (вместе с актином) сократительные волокна мышечных клеток, помимо вовлечения в движение других типов клеток. Таким образом, эти определения объясняют принципиальную разницу между кинезином и миозином.
Тип нитей
Основное различие между кинезином и миозином заключается в том, что кинезин движется вдоль микротрубочек цитоскелета, а миозин движется вдоль актиновых микрофиламентов.
Роль
Кинезин важен для формирования веретенообразного аппарата, в то время как миозин важен для подвижности клеток, деления клеток и мышечных сокращений. Следовательно, это еще одно различие между кинезином и миозином.
Заключение
Кинезин — это вид моторного белка, который перемещается по микротрубочкам вместе с их грузом. Особенно это касается формирования шпиндельного аппарата. С другой стороны, миозин — это другой тип моторного белка. Он движется вдоль актиновых микрофиламентов. Как правило, миозин отвечает за мышечные сокращения и подвижность клеток. Следовательно, основным отличием кинезина от миозина является тип молекулярных треков, которые они используют для движения, и их роль.
Ссылка:
1. Стенойен Д.Л., Брэди С.Т. Молекулярные моторы: кинезин, динеин и миозин. В: Siegel GJ, Agranoff BW, Albers RW и др., Редакторы. Базовая нейрохимия: молекулярный, клеточный и медицинский аспекты. 6-е издание. Филадельфия: Липпинкотт-Ворон; 1999.
Миозин
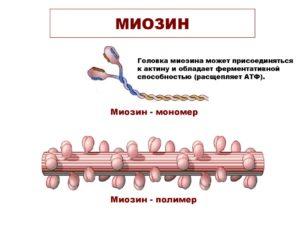
миозин и актин, миозин фотоМиозин — фибриллярный белок, один из главных компонентов сократительных волокон мышц — миофибрилл. Составляет 40—60 % общего количества мышечных белков. При соединении миозина с другим белком миофибрилл (актином) образуется актомиозин — основной структурный элемент сократительной системы мышц.
Другое важное свойство миозина — способность расщеплять аденозинтрифосфорную кислоту (АТФ). Благодаря АТФ-азной активности миозина, химическая энергия макроэргических связей АТФ превращается в механическую энергию мышечного сокращения
Молекулярная масса миозина около 500 000.
При действии протеолитических ферментов миозин распадается на фрагменты — тяжёлый меромиозин и лёгкий меромиозин (молекулярная масса около 350 000 и около 150 000). С помощью меченного тяжёлого меромиозиона при цитологических исследованиях выявляется местоположение актиновых микрофиламентов в клетке.
- 1 Структура
- 2 Виды миозина
- 2.1 Мышечный миозин
- 2.2 Немышечный миозин
- 3 Примечания
- 4 См. также
Структура
Миозины — семейство белков, являющихся моторами цитоскелета системы микрофиламентов. Миозины состоят из тяжёлых цепей (H) и лёгких (L) в разном количестве в зависимости от типа миозина. H-цепь имеет 2 участка — «головку» и «хвостик».
Головка тяжёлой цепи миозина имеет сайт связывания с актином и сайт связывания АТФ. По количеству «головок» миозины делятся на «традиционные» (convention myosin) — 2 головки, и нетрадиционные (unconvention myosin) — одна «головка».
Традиционные миозины могут связываться между собой в протофибриллы, а нетрадиционные — не могут.
На электронных микрофотографиях молекулы миозина имеют вид палочек (1600´25) с двумя глобулярными образованиями на одном из концов. Полагают, что 2 полипептидные цепи, образующие миозина, скручены в спираль. Белки, аналогичные миозину, обнаружены в жгутиках, ресничках и других двигательных структурах у многих простейших и бактерий, сперматозоидов животных и некоторых растений.
Мышечный миозин
Мышечный миозин (т. н. Миозин II) — традиционного типа. Обнаруживается в поперечно-полосатой мускулатуре позвоночных и беспозвоночных животных, в гладкомышечных клетках беспозвоночных. Мышечный миозин всегда состоит из двух H-цепей, по 200 кДа каждая, образующих две «головки» молекулы и скрученный из двух хвостиков тяжёлой цепи хвост.
Две лёгкие L-цепи по 18 кДа ассоциированы с тяжёлыми цепями в районе перехода от головки к хвосту. Связываясь с микрофиламентами головками попеременно, миозины как бы «шагают» по нему за счёт гидролиза макроэргической связи молекулы АТФ.
При этом к хвосту молекулы может быть присоединена соседняя микрофибрилла, и тогда происходит мышечное сокращение.
Немышечный миозин
Миозин V
Немышечные миозины встречаются в разных клетках, в том числе в гладко-мышечных клетках позвоночных. Немышечные миозины могут быть 2-х-головые и одно-головые, то есть традиционные и нетрадиционные.
Нетрадиционные миозины найдены во всех клетках. Они не могут образовывать протофиламенты. Одноголовый миозин тащит груз от (-) конца микрофиламента к (+)-концу.
Миозин I — в фоторецепторах, миозин VII — в органах слуха.
См. также
п·о·р Биологические двигатели
| Актин • Динеин • Кинезин • Миозин • Тропомиозин • Тропонин • Флагеллин |
| См. также: Молекулярные моторы |
миозин, миозин и актин, миозин и актин титин, миозин фото, миозински филаменти
Миозин Информацию О
Миозин
МиозинМиозин Вы просматриваете субъектМиозин что, Миозин кто, Миозин описание
There are excerpts from wikipedia on this article and video
Поисковая система, разработанная для вас, доставляет вам самую актуальную и точную информацию с простым дизайном и системой быстрого функционирования. Вы можете найти почти любую информацию, которую вы ищете на нашем сайте.
На данный момент мы служим только на английском, турецком, русском, украинском, казахском и белорусском языках. Очень скоро в систему будут добавлены новые языки.
Жизнь известных людей дает вам информацию, изображения и видео о сотнях тем, таких как политики, правительственные деятели, врачи, интернет-сайты, растения, технологические транспортные средства, автомобили и т. д.
Азбучные истины
Начнем с азов — собственно, с классической теории мышечного
сокращения. Базовая сократительная единица мышечной ткани называется
саркомером. Края саркомера — Z-диски — состоят
из переплетающихся нитей различных белков. К одному
из этих белков цепляются актиновые микрофиламенты, вдоль которых тянутся регуляторные белки тропонин и тропомиозин (рис. 2). Другой белок — титин,
самый большой из известных в настоящее время белков, —
крепится к соседнему участку Z-диска и служит длинной-длинной
основой, с которой связываются молекулы белка миозина.
Таким образом, саркомер состоит из чередующихся тонких
(образованных многочисленными молекулами актина и регуляторными белками)
и толстых (состоящих из тоже многочисленных молекул миозина и
вспомогательных белков) нитей.
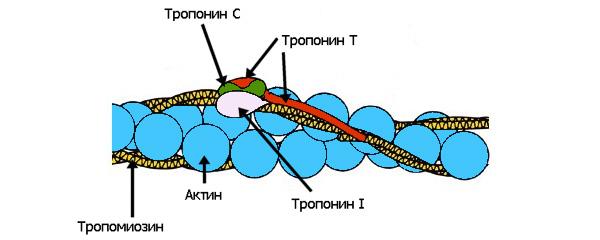 Рис. 2. Актиновые Рис. 2. Актиновыемикрофиламенты обмотаны регуляторными белками — тропомиозином и прикрепленным к нему тропонином, состоящим из трех различных субъединиц. Когда в мышечной клетке нет ионов кальция, тропомиозин загораживает миозину сайт связывания с актином. Однако когда ионы кальция есть, они присоединяются к тропонину, который меняет свою конформацию и перестает удерживать тропомиозин на актиновых нитях. В результате актиновые сайты оказываются открыты для связывания, миозиновые головки могут прицепиться к ним, и мышечное сокращение становится возможным. Изображение с сайта www.med4you.at |
И вот начинается кое-что интересное. Импульс, подошедший
к нервно-мышечному соединению, вызывает повышение внутриклеточного
уровня кальция. Кальций присоединяется к регуляторным белкам,
которые обматывали актин и загораживали его от миозина,
в результате чего эти белки смещаются, и головка миозина,
содержащая продукты гидролиза АТФ,
приникает к молекуле актина. В результате различных
пертурбаций (которые подробно описаны ниже), миозин крепко сцепляется
с актином и меняет свою конформацию, поворачивая хвост относительно
головки и выплевывая продукты гидролиза. Это происходит
на множестве миозиновых головок и приводит к тому, что
актиновая нить чуть-чуть сдвигается относительно миозиновой. Затем
крепко сцепленный с актиновой нитью миозин связывается с АТФ,
отцепляется от актина и претерпевает обратные конформационные
изменения — то есть отворачивает хвост обратно (рис. 3).
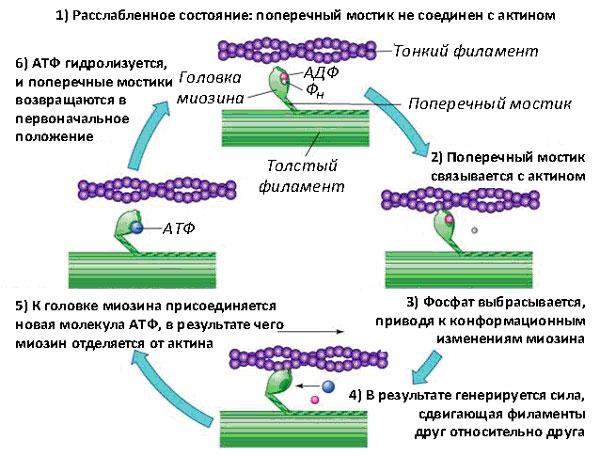 Рис. 3. Схема мышечного сокращения (классический цикл Лимна–Тейлора) Рис. 3. Схема мышечного сокращения (классический цикл Лимна–Тейлора)
|
Так, перебирая головками, миозиновые молекулы и обеспечивают работу
мышцы. Расслабление же мышц происходит тогда, когда к мышечной
клетке перестал подходить импульс и в нее перестал поступать
кальций. Тогда отцепившиеся друг от друга актиновые и миозиновые
нити постепенно возвращаются в свое первоначальное положение
(отчасти благодаря эластичным свойствам молекул титина), и мышца
расслабляется.
|
|
Вообще, способность миозина двигаться вдоль актиновой нити — это
слишком удобное свойство, чтобы использовать его только
для мышечного сокращения. Поэтому множество различных видов миозина
(их еще называют «миозиновыми моторами», их филогенетическое дерево
показано на рис. 4) применяется разными видами клеток
для множества разнообразных функций — помимо собственно
сокращения мышц они могут обеспечивать внутриклеточный транспорт,
двигать трансмембранные белки и так далее (рис. 5).
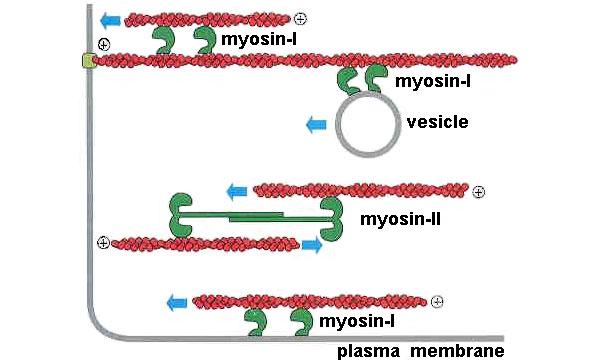 Рис. 5. Вот примеры Рис. 5. Вот примерыфункций, которые могут выполнять в клетке миозины различных видов. Они могут тянуть вдоль актиновой нити какой-либо груз (в данном случае везикулу), могут сдвигать актиновую нить относительно другой актиновой нити либо относительно мембраны и могут, наконец, обеспечивать мышечное сокращение. Изображение из слайдов к лекции А. К. Цатуряна на Зимней школе |
Различные миозины сильно отличаются друг от друга
по строению (рис. 6): они могут быть одноголовыми или
двухголовыми, с длинными или короткими хвостами; однако главная
функциональная часть — головка — имеет практически одинаковое
строение у всех видов миозина. То есть принцип работы миозина
одинаков во всех случаях, а детали (например, размер хвоста)
обеспечивают ту или иную специализацию.
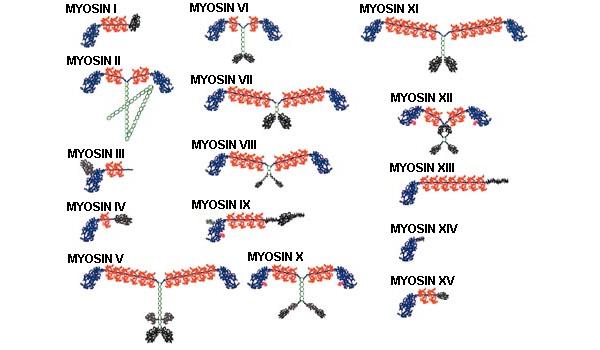 Рис. 6. Вот какие разные бывают миозины. Изображение из слайдов к лекции А. К. Цатуряна на Зимней школе Рис. 6. Вот какие разные бывают миозины. Изображение из слайдов к лекции А. К. Цатуряна на Зимней школе
|
Миозины — это не единственные моторные белки. Помимо них существует еще два класса моторов — динеины и кинезины.
В отличие от миозинов, которые двигаются по актиновой
нити, динеины и кинезины бегают по микротрубочкам, причем
динеины — только в одну сторону, а кинезины — только
в противоположную.
Структура миофибрилл
Исследования мышечного волокна сегодня проводятся на основе рентгеноструктурного анализа, электронной микроскопии, а также гистохимическими методами.
Рассчитано, что в каждую миофибриллу, диаметр которой составляет 1 мкм, входит примерно 2500 протофибрилл, то есть удлиненных полимеризованных молекул белков (актина и миозина). Актиновые протофибриллы в два раза тоньше миозиновых. В покое эти мышцы находятся так, что актиновые нити кончиками проникают в промежутки между миозиновыми протофибриллами.
Узкая светлая полоса в диске А свободна от актиновых нитей. А мембрана Z скрепляет их.
На миозиновых нитях есть поперечные выступы длиной до 20 нм, в головках которых находится порядка 150 молекул миозина. Они отходят биополярно, и каждая головка соединяет миозиновую с актиновой нитью. Когда происходит усилие актиновых центров на нитях миозина, актиновая нить приближается к центру саркомера. В конце миозиновые нити доходят до линии Z. Тогда они занимают собой весь саркомер, а актиновые находятся между ними. При этом длина диска I сокращается, а в конце он исчезает полностью, вместе с чем линия Z становится толще.
Так, по теории скользящих нитей, объясняется сокращение длины волокна мышцы. Теория, получившая название «зубчатого колеса», была разработана Хаксли и Хансоном в середине двадцатого века.
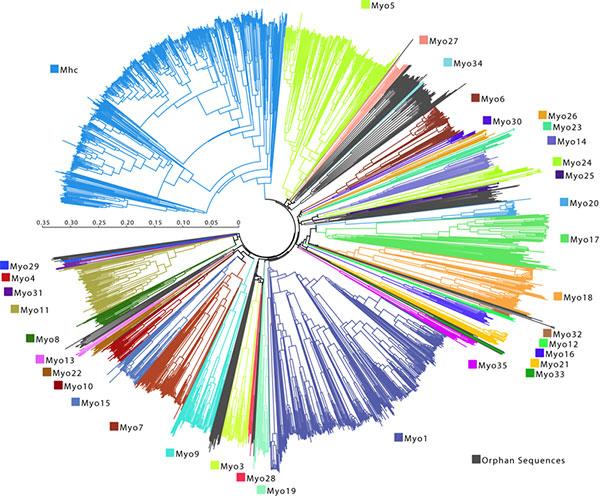 Рис. 4. Устрашающая
Рис. 4. Устрашающая