Митохондрия
Содержание:
- Происхождение митохондрий
- Гипоэнергетические состояния
- Бактерии
- Значение
- Митохондрии
- Не все клетки одинаковые
- Разобщители
- ссылки
- Контроль окислительного фосфорилирования
- Анаэробный синтез АТФ: субстратное фосфорилирование, синтез АТФ из фосфокреатина, аденилаткиназная реакция[править | править код]
- Синтез АТФ путем субстратного фосфорилированияправить | править код
- Получение АТФ из фосфокреатинаправить | править код
- Креатин выводится в форме креатининаправить | править код
- Прием креатина повышает работоспособностьправить | править код
- Образование АТФ из АДФ под действием аденилаткиназыправить | править код
Происхождение митохондрий
Основная статья: Симбиогенез
В соответствии с теорией симбиогенеза, митохондрии появились в результате захвата примитивными клетками (прокариотами) бактерий. Клетки, которые не могли сами использовать кислород для генерации энергии, имели серьёзные ограничения в возможностях развития; бактерии же (прогеноты) могли это делать. В процессе развития таких отношений прогеноты передали множество своих генов сформировавшемуся, благодаря повысившейся энергоэффективности, ядру теперь уже эукариот. Вот почему современные митохондрии больше не являются самостоятельными организмами. Хотя их геном кодирует компоненты собственной системы синтеза белка, многие ферменты и белки, необходимые для их функционирования, кодируются ядерными хромосомами, синтезируются в цитоплазме клетки и только потом транспортируются в органеллы.
Гипоэнергетические состояния
Причиной гипоэнергетических состояний может быть следующее:
- гиповитаминозы экзогенные и/или эндогенные – снижается скорость и эффективность окислительных реакций. Возникает обычно при нехватке витаминов – В1, В2, никотиновой кислоты, В6, пантотеновой кислоты и аскорбиновой кислоты,
- дефицит белка в пище – снижается синтез всех ферментов и ферментов катаболизма в частности,
- снижение потребления углеводов и липидов как основных источников энергии,
- дефицит кислорода – отсутствие акцептора для электронов вызывает «переполнение» дыхательных ферментов, накопление НАДН и ФАДН2 в клетке и прекращение катаболизма,
- дефицит железа – компонента цитохромов, миоглобина и гемоглобина, и меди – компонента цитохромоксидазы.
Бактерии
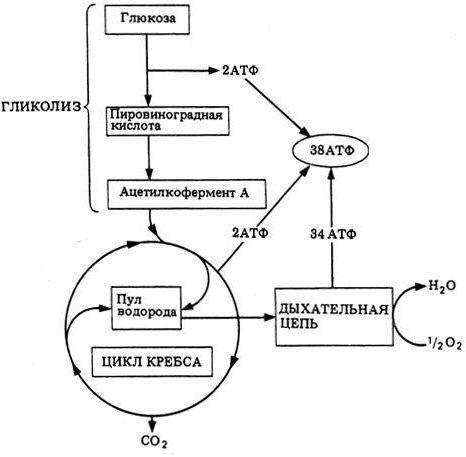
Более трёх с половиной миллиардов лет назад появились первые живые организмы на нашей планете. Жизнь зародилась на Земле благодаря тому, что появившиеся бактерии — прокариотические организмы (не имеющие ядра) разделились на два вида по принципу дыхания и питания. По дыханию — на аэробные и анаэробные, а по питанию — на гетеротрофные и автотрофные прокариоты. Это напоминание вряд ли будет излишним, потому что фосфорилирование окислительное невозможно объяснить без базовых понятий.
Итак, прокариоты по отношению к кислороду (физиологическая классификация) делятся на аэробные микроорганизмы, которым свободный кислород безразличен, и аэробные, жизнедеятельность которых полностью зависит от его наличия. Именно они и осуществляют фосфорилирование окислительное, находясь в среде, насыщенной свободным кислородом. Это наиболее широко распространённый метаболический путь с высокой энергетической эффективностью сравнительно с анаэробным брожением.
Значение
Субстратное фосфорилирование служит для быстрой регенерации АТФ независимо от доступности акцепторов электронов для дыхательной цепи переноса, то есть в отсутствии кислорода. У человека в эритроцитах полностью отсутствует аэробное дыхание и вся энергия генерируется исключительно за счёт субстратного фосфорилирования гликолиза. При недостатке кислорода мышцы также получают энергию именно по этому пути или за счёт креатинфосфата.
Также субстратное фосфорилирование способствует более полному использованию энергии окисляемых веществ. Без него часть энергии просто бы терялась, превращаясь в теплоту.
Митохондрии
Митохондрии представляют собой мембранные органеллы, присутствующие в клетках практически всех эукариотических организмов. Митохондрии заключены в две мембраны: внешняя, находящаяся в контакте с цитоплазмой, и мембрана, ограничивающая внутреннюю часть митохондрий. Между этими двумя мембранами находится межмембранное пространство. Внутренняя часть митохондрий заполнена матриксом. Типичная эукариотическая клетка содержит около 2000 митохондрий.
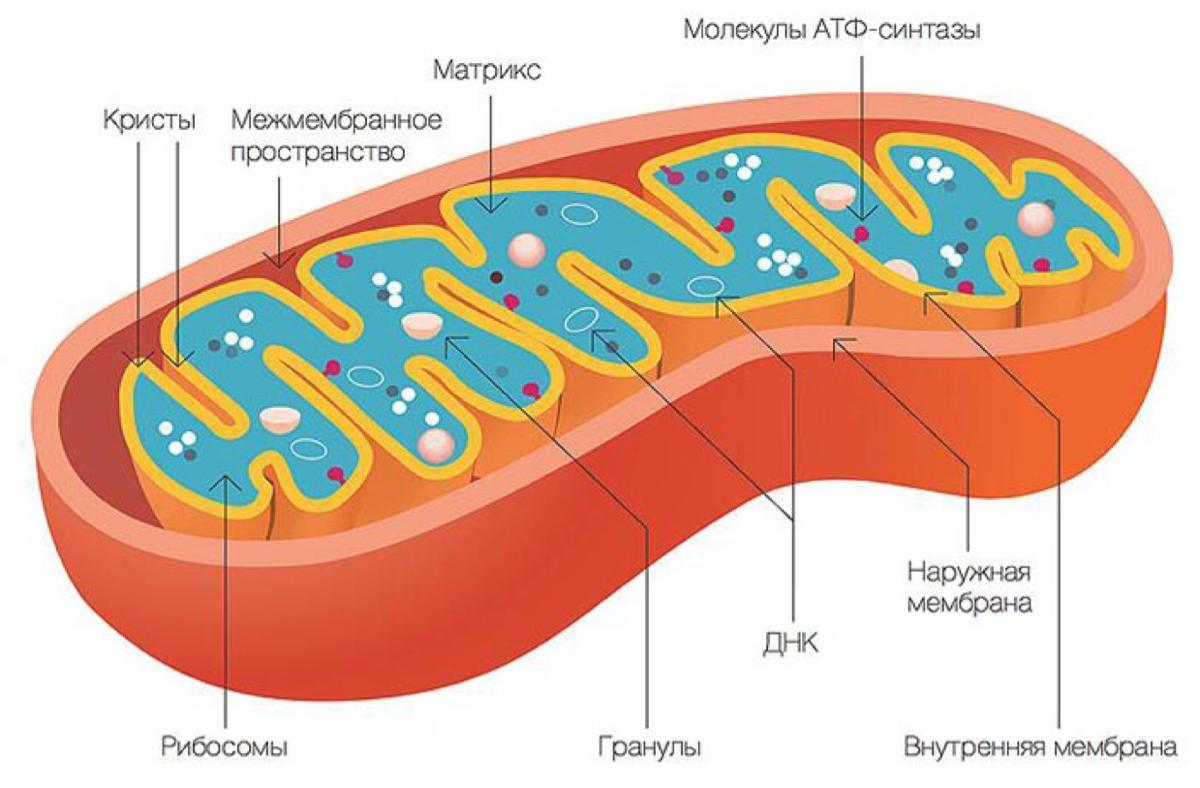
Внешняя митохондриальная мембрана определяет форму этой органеллы и, благодаря наличию каналообразующего белка (порина), проницаема для определенных молекул.
Внутренняя митохондриальная мембрана имеет в несколько раз большую площадь поверхности, чем наружная мембрана. Ее поверхность значительно увеличивают кристы, ориентированные к центру органеллы. Кристы могут различаться по количеству, размеру и форме, при этом они имеют частицы, прикрепленные к ним с помощью коротких ручек. Эти частицы содержат АТФ-синтазы, ферментный комплекс, участвующий в синтезе АТФ.
Матрикс заполняет внутреннюю часть митохондрий и представляет собой смесь нескольких сотен ферментов, которые преобразуют продукты метаболизма углеводов, липидов и белков через цикл Кребса в углекислый газ и воду с выделением энергии в виде молекул АТФ. В этом процессе электроны переносятся по дыхательной электронной цепи, и происходит синтез высокоэнергетического фосфатного соединения, АТФ (окислительное фосфорилирование).
Не все клетки одинаковые
Клетка может представлять из себя как «кирпичик» многоклеточного организма, так и целый организм. За небольшим исключением, почти все клетки содержат генетический материал (ДНК и РНК), который регулирует метаболизм и синтез белков. Однако не у всех живых организмов клетки организованы одинаково. Поэтому на основании различий в клеточной организации выделяют две группы: эукариоты и прокариоты.
Растения, животные и грибы являются эукариотами и имеют высокоупорядоченные клетки. Их генетический материал упакован в центральное ядро, которое окружено специализированными клеточными компонентами, называемыми органеллами. Органеллы, такие как митохондрии, шероховатый эндоплазматический ретикулум и аппарат Гольджи, работают как хорошо отлаженный конвейер. Одни производят энергию, другие синтезируют и упаковывают белки, третьи транспортируют их в различные части клетки и за ее пределы. Ядро, как и большинство эукариотических органелл, связано мембранами, которые регулируют вход и выход белков, ферментов и другого клеточного материала в органеллу и из нее.
Прокариоты, с другой стороны, являются одноклеточными организмами, такими как бактерии и археи. Прокариотические клетки менее структурированы, чем эукариотические. У них нет ядра. Вместо этого их генетический материал свободно плавает в клетке. У них нет многих мембраносвязанных органелл, обнаруженных в эукариотических клетках, в том числе нет митохондрий.
Разобщители
Состояние, когда окисление субстратов продолжается, а фосфорилирование не происходит (то есть, АТФ не образуется из Ф и АДФ), — это разобщение фосфорилирования и окисления. Такое случается, когда в процесс вмешиваются разобщители. Что они из себя представляют и к каким результатам стремятся? Допустим, синтез АТФ сильно снижен, то есть в меньшем количестве синтезируется, а дыхательная цепь при этом функционирует. Что происходит с энергией? Она выделяется как тепло. Все ощущают такое во время болезни с повышенной температурой тела.
Температурите? Значит, поработали разобщители. Например, антибиотики. Это слабые кислоты, которые растворяются в жирах. Проникая в межмембранное пространство клетки, они диффундируют в матрикс, утягивая за собой связанные протоны. Разобщительным действием, например, обладают гормоны, выделяемые щитовидной железой, которые содержат йод (трийодтиронин и тироксин). Если щитовидная железа гиперфункционирует, состояние больных ужасное: им недостаёт энергии АТФ, они потребляют очень много пищи, поскольку организм требует для окисления много субстратов, но в весе теряют, поскольку основная часть получаемой энергии уходит в виде тепла.
ссылки
- Альбертс Б., Брей Д., Хопкин К., Джонсон А., Льюис Дж., Рафф М., Робертс К. и Уолтер П. (2004). Основная клеточная биология. Нью-Йорк: Наука Гирлянды.
- Купер Дж. М., Хаусман Р. Э. и Райт Н. (2010). Клетка. (с. 397-402). Марбан.
- Девлин Т. М. (1992). Учебник биохимии: с клиническими соотношениями. John Wiley & Sons, Inc.
- Garrett, R. H. & Grisham, C.M. (2008). биохимия. Томсон Брукс / Коул.
- Lodish, H., Darnell, J.E., Berk, A., Kaiser, C.A., Krieger, M., Scott, M.P., & Matsudaira, P. (2008). Молекулярно-клеточная биология. Macmillan.
- Нельсон Д.Л. и Кокс М.М. (2006). Lehninger Принципы биохимии 4-е издание. Эд Омега. Барселона.
- Voet, D. & Voet, J. G. (2006). биохимия. Ed. Panamericana Medical.
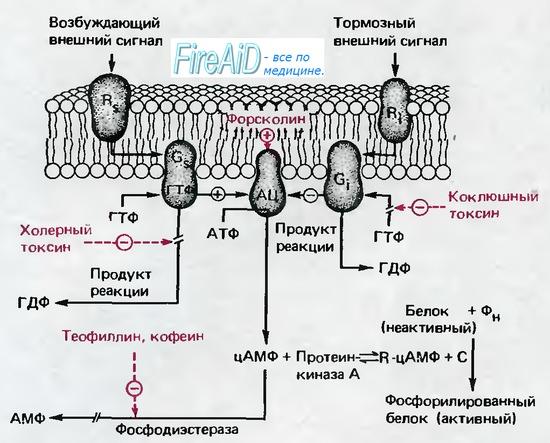
Контроль окислительного фосфорилирования
Скорость использования АТФ в клетках контролирует их синтез, и, в свою очередь, благодаря связыванию окислительного фосфорилирования с цепью транспорта электронов, она также регулирует скорость электронного транспорта в целом..
Окислительное фосфорилирование строго контролируется, что гарантирует, что АТФ не генерируется быстрее, чем потребляется. Существуют определенные шаги в процессе транспорта электронов и сопряженного фосфорилирования, которые регулируют скорость производства энергии..
Скоординированный контроль производства АТФ
Основными путями производства энергии (клеточный АТФ) являются гликолиз, цикл лимонной кислоты и окислительное фосфорилирование. Скоординированный контроль этих трех процессов регулирует синтез АТФ.
Управление фосфорилированием по соотношению массового действия АТФ зависит от точного вклада электронов в транспортную цепь. Это в свою очередь зависит от отношений / который сохраняется повышенным под действием гликолиза и цикла лимонной кислоты.
Этот скоординированный контроль осуществляется путем регулирования контрольных точек гликолиза (PFK ингибируется цитратом) и цикла лимонной кислоты (пируватдегидрогеназа, цитратная лента, изоцитратдегидрогеназа и α-кетоглутаратдегидрогеназа).
Управление акцептором
Комплекс IV (цитохром с оксидаза) представляет собой фермент, регулируемый одним из его субстратов, что означает, что его активность контролируется восстановленным цитохромом с (с2+), который, в свою очередь, находится в равновесии с отношением концентраций между / и массовое отношение действия / + [PЯ].
Чем выше отношение / +] и опустите / + [PЯ], чем больше будет концентрации цитохрома и активность комплекса IV будет выше. Это интерпретируется, например, если мы сравним организмы с различной активностью отдыха и высокой активностью.
У человека с высокой физической активностью потребление АТФ и, следовательно, его гидролиз до АДФ + РЯ будет очень высоким, вызывая разницу в соотношении массовых воздействий, что вызывает увеличение и, следовательно, увеличение синтеза АТФ. В состоянии покоя происходит обратная ситуация.
В конце концов, скорость окислительного фосфорилирования увеличивается с концентрацией АДФ в митохондриях. Эта концентрация зависит от ADP-ATP транслокаторов, ответственных за транспорт адениновых нуклеотидов и PЯ от цитозоля до митохондриального матрикса.
Отключающие агенты
На окислительное фосфорилирование влияют определенные химические агенты, которые позволяют электронному транспорту продолжаться без фосфорилирования ADP, отделяя производство и сохранение энергии.
Эти агенты стимулируют скорость потребления кислорода митохондриями в отсутствие АДФ, также вызывая увеличение гидролиза АТФ. Они действуют, устраняя посредника или нарушая энергетическое состояние цепи переноса электронов..
2,4-динитрофенол, слабая кислота, которая проходит через митохондриальные мембраны, отвечает за рассеивание градиента протонов, поскольку они связываются с ними на кислотной стороне и высвобождают их на основной стороне..
Это соединение использовалось в качестве «таблетки для похудения», поскольку было обнаружено, что оно вызывает увеличение дыхания, следовательно, увеличение скорости метаболизма и связанной с этим потери веса. Тем не менее, было показано, что его отрицательный эффект может даже привести к смерти.
Рассеяние протонного градиента производит тепло. Клетки жировой ткани коричневого цвета используют выделение, контролируемое гормонально, для выработки тепла. Спящие млекопитающие и новорожденные, лишенные волос, состоят из этой ткани, которая служит своего рода тепловым одеялом.
ингибиторы
Соединения или ингибирующие агенты предотвращают как потребление O2 (электронный транспорт) как связанное окислительное фосфорилирование. Эти агенты предотвращают образование АТФ с помощью энергии, вырабатываемой в электронном транспорте. Таким образом, транспортная цепочка останавливается, когда это потребление энергии не доступно.
Антибиотик олигомицин действует как ингибитор фосфорилирования у многих бактерий, предотвращая стимуляцию АДФ к синтезу АТФ.
Существуют также ионофорные агенты, которые образуют жирорастворимые комплексы с такими катионами, как К+ и на+, и они проходят через митохондриальную мембрану с указанными катионами. Затем митохондрии используют энергию, вырабатываемую в электронном транспорте, для накачки катионов вместо синтеза АТФ.
Анаэробный синтез АТФ: субстратное фосфорилирование, синтез АТФ из фосфокреатина, аденилаткиназная реакция[править | править код]
Рис. 10.1. Строение аденозинтрифосфата (АТФ)
Молекулы АТФ жизненно необходимы. АТФ служит источником энергии, необходимой для сокращения мышц, проведения нервного импульса, протекания многих биохимических реакций и т.п. В покое расходуется 28 г (1 унция) АТФ в минуту, что эквивалентно 1,4 кг (3 фунта) в час, а при физической нагрузке расход АТФ достигает 0,5 кг в минуту! АТФ состоит из аденина, рибозы и трех фосфатных групп, которые называются а-, β- и у-фосфатными группами (рис. 10.1). Гидролиз высокоэнергетических фосфоангидридных связей между β- и у-атомами фосфора или между а- и β-атомами фосфора высвобождает энергию, необходимую для проведения биохимических реакций, т.е. для поддержания жизни организма.
Самый энергетически выгодный метод синтеза АТФ — это аэробное окислительное фосфорилирование. Однако АТФ может также образоваться в анаэробных условиях, хотя и с меньшей эффективностью. Существует три способа анаэробного синтеза АТФ: субстратное фосфорилирование, образование АТФ из фосфокреатина и в результате аденилаткиназной реакции
Хотя анаэробный синтез АТФ и не так энергетически выгоден, способность синтезировать АТФ в бескислородной среде может иметь жизненно важное значение.
Синтез АТФ путем субстратного фосфорилированияправить | править код
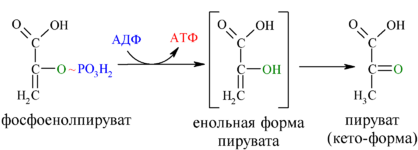
На рис. 10.2 показано, что АТФ образуется в процессе гликолиза в ходе фосфоглицераткиназной и пируваткиназной реакций, а также в цикле Кребса в ходе реакции, катализируемой ферментом сукцинил-КоА-синтетазой с участием нуклеозидцифосфаткиназы (рис. 10.3). Примечание: для этих реакций кислород не требуется.
Получение АТФ из фосфокреатинаправить | править код
Фосфокреатин — это «аварийный запас» высокоэнергетического фосфата, который можно использовать для быстрого образования АТФ, необходимого для сокращения мышц в
анаэробных условиях. Этот интенсивный механизм синтеза АТФ может в экстренных ситуациях спасти жизнь; однако запасы фосфокреатина расходуются очень быстро, всего за несколько секунд.
В периоды покоя, когда молекул АТФ много, креатинкиназа фосфорилирует креатин с образованием фосфокреатина. Особенно важна роль этой реакции в мышцах. Если вдруг требуется сделать резкий рывок, фосфокреатин фосфорилирует АДФ до АТФ, необходимого для сокращения мышц (рис. 10.4) По этой причине фосфокреатин еще называют «фосфаген».
Рис. 10.4. Образование АТФ из фосфокреатина при физической нагрузке и синтез фосфокреатина из креатина в период покоя
Креатин выводится в форме креатининаправить | править код
Креатин — это аминокислота, не входящая в состав белков. Креатин синтезируется из аргинина и выводится с мочой в форме креатинина. Уровень креатинина в крови и клиренс креатинина используются для оценки скорости клубочковой фильтрации при нарушении работы почек. Примечание: не путайте креатин, креатинин и карнитин.
Прием креатина повышает работоспособностьправить | править код
Эргогенные средства — это вещества, которые повышают скорость, силу или выносливость спортсмена. Многие из них опасны и запрещены к использованию. Мнения противоречивы, тем не менее многие ученые сходятся на том, что креатин — единственное эргогенное средство, для которого научно доказано его свойство повышать работоспособность как при спринтерских, так и при продолжительных нагрузках.
Образование АТФ из АДФ под действием аденилаткиназыправить | править код
После того как АТФ гидролизуется для высвобождения энергии, необходимой для сокращения мышц, в клетках образуется и накапливается АДФ. Но АДФ тоже содержит энергоемкую а-фосфоангидридную связь (рис. 10.1). Природа изобретательна: эта энергия становится доступной после того, как в анаэробных условиях две молекулы АДФ под действием аденилаткиназы образуют АТФ (рис. 10.5) (раньше фермент аденилаткиназу называли миокиназой).
Рис. 10.5. Образование АТФ из двух молекул АДФ в процессе аденилаткиназной реакции