Протеинкиназы
Содержание:
- Введение опиоидного антагониста
- Действие на JNK и другие родственные МАРК белки
- Активация ПКА[править | править код]
- Циклический аденозинмонофосфат, цАМФ. цАМФ в регуляции функции клетки.
- Тирозиновые протеинкиназы
- Альфа-субъединица
- Бета-гамма-димер
- Функции[править | править код]
- Функции
- Нерецепторные тирозинкиназы
- Регуляция
- Механизм
- Необходимость димеризации
- Гистидин — специфичные протеинкиназы
Введение опиоидного антагониста
Интернализация Рц, кроме того, может служить одним из путей деградации сигнального соединения.
У мышей с нокаутированным геном Р-аррестина-1 не наблюдается практически никаких отклонений от нормы. Нокаут гена р~ аррестина-2 приводит к выраженным изменениям реакции на агонист опиоидных Рц морфин: возрастают сила и длительность его действия и не развивается толерантность после повторных инъекций . Вместе с тем Р-аррестин-2 не участвует в развитии зависимости от морфина: введение опиоидного антагониста налоксона через 3 дня применения морфина вызывает симптомы отмены как у интактных мышей, так и у мышей с нокаутированным геном р-аррестина-2. Одновременный нокаут генов р-аррестина-1 и р-аррестина-2 приводит к гибели эмбрионов.
Независимые от G-белков эффекты GPCRs
Помимо отмеченной выше функции р-аррестинов в десенситизации и интернализации Рц, аррестины, по-видимому, могут выполнять функцию адапторных молекул, облегчающих активацию и внутриклеточную локализацию сигнальных каскадов (в частности, МАРК каскадов). Так, показано зависимое от агониста Рц взаимодействие р-аррестина с нерецепторной тирозинкиназой src28. Члены семейства src участвуют в регуляции пролиферации и дифференцировки клеток, активации каскада ERK и интернализации Рц за счёт фосфорилирования динамина и клатрина. Р-Аррестины, по-видимому, выполняют зависимую от агониста функцию «лесов», соединяющих последовательные киназы каскада МАРК: киназу киназы МАРК – МАРККК, киназу МАРК — МАРКК и МАРК (например, RAF1, МЕК1 и ERK или ASK1, МАРКК4 и JNK3). Белки-«леса» облегчают межбелковые взаимодействия, придают специфичность путям проведения сигнала и обеспечивают правильную внутриклеточную локализацию белков (например, перемещение МАРК из клеточного ядра в цитоплазму). Интересно, что р-аррестины прямо взаимодействуют с 1-м и 3-м членами каскада (т.е. МАРККК и МАРК), но не с промежуточным членом МАРКК.
Действие на JNK и другие родственные МАРК белки
Активация МАРККК происходит при их взаимодействии с малыми G-белками (ГТФазами) семейства Ras, активируемыми при замене связанного ГДФ на ГТФ. Эта замена облегчается рядом белковых факторов, включая Sos (son of sevenless — белок, активируемый Рц, не содержащими 7 трансмембранных доменов), Ras-GRF (Ras protein-specific guanine nucleotide-releasing factor — специфичный в отношении белка Ras гуаниннуклеотид-рилизинг фактор), ЕРАС (exchange factor directly activated by cAMP — обменивающий фактор, прямо активируемый цАМФ) и затрудняется фактором Rap-GAPII (Rap-GTPase activating protein — белок, активирующий ГТФазу Rap). Регуляция активности этих факторов Ру-СЕ GPCRs может происходить через активацию рецепторных (RTKs) и нерецепторных тирозинкиназ (например, семейства Src). Активация RTKs приводит к созданию сайтов связывания белковых комплексов, включающих Sos, который в свою очередь активирует Ras. Активация фосфатидилинозитид-3-киназы PI3K происходит при прямом взаимодействии с GPy-CE. Родственный Ras белок Rapl может действовать на МАРК тканеспецифично, стимулируя или тормозя её активность. Активность Rapl реципрокно контролируется Get и Gas. Разнообразие путей действия GPCRs на МАРК создаёт основу для тканеспецифичности ответов на данный сигнал.
N-концевая киназа Jun (Jun N-terminal kinase, JNK) структурно сходна с МАРК. Аналоги Ras в каскадах активации JNK — Rac и Cdc42. Активировать Racl и Cdc42 могут Gpy-CE, а также Ga12 и Ga13. В качестве факторов, сопрягающих G-белки с Rac/Cdc, по-видимому, выступают факторы обмена гуаниновых нуклеотидов (GEFs) Tiaml и Dbl , взаимодействующие с Rac посредством домена гомологии Dbl (DH-домена). Промежуточными факторами могут быть адапторные белки Crk или паксиллин, рекрутируемые PYK2 (proline-rich tyrosine kinase — богатая пролином тирозинкиназа 2) и FAK (киназа точечной адгезии, focal adhesion kinase). Goc12 способна активировать JNK также в обход Rac/Cdc, действуя через одну из киназ МЕКК — ASK1.
Активация ПКА[править | править код]
- В неактивном состоянии протеинкиназа A является тетрамером: две её каталитические (К) субъединицы ингибированы двумя регуляторными (R) субъединицами.
- При присоединении к каждой регуляторной субъединице двух молекул цАМФ происходит диссоциация всех четырех субъединиц, а также активация каталитических субъединиц, которые могут фосфорилировать остатки серина и треонина в различных ферментах и других белках. Такое фосфорилирование регулирует активность этих белков.
Синтез цАМФправить | править код
цАМФ является аллостерическим эффектором протеинкиназ A и ионных каналов. цАМФ синтезируется аденилатциклазами, которые закреплены в плазматической мембране клетки.
Ферменты фосфодиэстеразы катализируют расщепление цАМФ, при этом образуется АМФ. Аденилатциклазы ингибируются цАМФ при высоких концентрациях метилированных производных ксантина, например, кофеина.
Циклический аденозинмонофосфат, цАМФ. цАМФ в регуляции функции клетки.
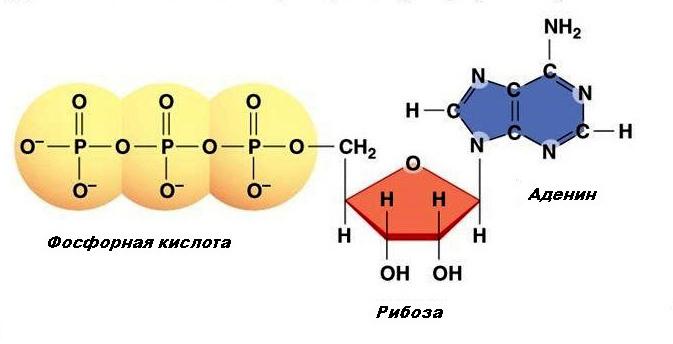
В последнее время доказано, что циклический аденозинмонофосфат (цАМФ), производное основного источника энергии в организме- АТФ, является важным вторым посредником. Сложная цепь реакций, показанная на рис. 1.15, начинается с рецептора Rs на наружной поверхности плазматической мембраны, который может служить местом специфического связывания для различных медиаторов и гормонов. После связывания со специфической «стимулирующей» молекулой Rs изменяет свою конформацию; эти изменения влияют на белок Gs на внутренней поверхности мембраны таким образом, что становится возможной активация последнего внутриклеточным гуанозинтрифосфатом (ГТФ). Активированный белок Gs, в свою очередь, стимулирует фермент на внутренней поверхности мембраны-аденилатциклазу (АЦ), которая катализирует образование цАМФ из АТФ. Водорастворимый цАМФ и является посредником, передающим эффект стимуляции внеклеточного рецептора Rs к внутренним структурам клетки.
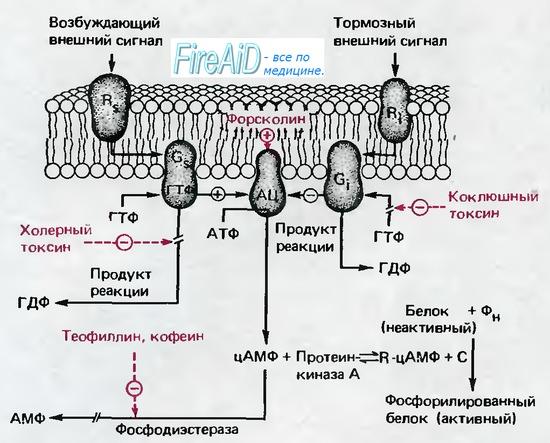
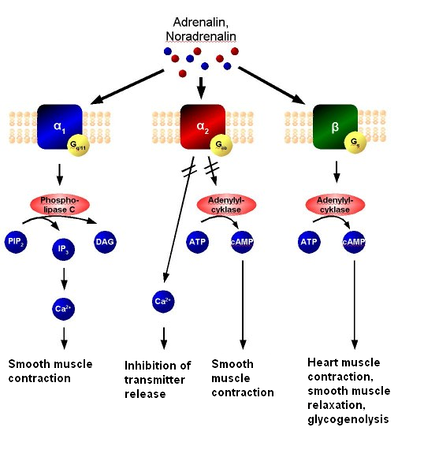
Параллельно со стимуляторной цепью реакций с участием Rs возможно связывание тормозных медиаторов и гормонов с соответствующим рецептором Ri, который опять-таки через ГТФ-активи-руемый белок Gi; ингибирует АЦ и, таким образом, продукцию цАМФ. Диффундируя в клетку, цАМФ реагирует с аденилаткиназой (А-киназа); при этом высвобождается субъединица С, которая катализирует фосфорилирование белка Р. Это фосфорилирование переводит белки в активную форму, и теперь они могут проявить свое специфическое регулирующее действие (например, вызвать деградацию гликогена). Эта сложная регуляторная система чрезвычайно эффективна, так как конечным результатом является фосфорилирование множества белков, т. е. регуляторный сигнал проходит цепь с большим коэффициентом усиления. Наружные медиаторы, которые связываются с рецепторами Rs и Ri, специфическими для каждого из них, чрезвычайно разнообразны. Адреналин, связываясь с Rs или Ri, участвует в регуляции метаболизма липидов и гликогена, а также в усилении сокращения сердечной мышцы и в других реакциях.
Тиреотропный гормон, активируя Rss, стимулирует выделение щитовидной железой гормона тироксина, а простагландин I тормозит агрегацию кровяных пластинок. Ингибиторные эффекты, в том числе адреналина, опосредованные через Ri, выражаются в замедлении липолиза. Таким образом, система цАМФ-это многофункциональная внутриклеточная регуляторная система, которая может точно контролироваться внеклеточными стимуляторными и ингибиторными сигнальными веществами.
Тирозиновые протеинкиназы
Аминокислота L-тирозин
Тирозиновые протеинкиназы — ферменты, которые переносят фосфатную группу от АТФ на остаток аминокислоты тирозина в белке. Большинство тирозиновых киназ имеют сопряженные тирозинфосфатазы. Тирозиновые киназы классифицируют на две группы: цитоплазматические и трансмембранные (связанные с рецептором).
Цитоплазматические протеинкиназы
Геном ретровирусов (в том числе, вируса саркомы Рауса) может содержать ген v-src (viral-sarcoma), который является онкогеном; этот ген не содержит кода для С-концевого участка, отвечающего за ингибирование фосфорилирования, поэтому фермент — продукт вирусного гена — постоянно активен в клетке, чем отличается от c-src (клеточного гена), который активируется только некоторыми внешними сигналами (например, факторами роста), и является протоонкогеном.
TCR (T-cell receptor, рецептор антигена Т-лимфоцитов), передает сигнал внутрь клетки путём активирования двух белков: Lck и Fyn, относящихся к семейству Src. Этот сигнал приводит к пролиферации Т-лимфоцитов и усилению клеточного иммунитета.
Рецепторы с тирозинкиназной активностью
Рецепторы с тирозинкиназной активностью в зависимости от их субстратов фосфорилирования подразделяют на двадцать семейств (эпителиального фактора роста, инсулина, фактора роста тромбоцитов и другие). Инсулиновый рецептор является мультимерным комплексом, однако большинство рецепторов с тирозинкиназной активностью имеют только одну субъединицу. Каждый мономер имеет один трансмембранный домен, состоящий из 25-38 аминокислотных остатков, внеклеточный N-концевой домен и внутриклеточный C-концевой домен. Внеклеточный домен очень крупный и отвечает за связывание эндогенных лигандов-агонистов (факторов роста или гормонов); внутриклеточный участок содержит домены, обладающие киназной активностью. Когда фактор роста или гормон соединяется с внеклеточным доменом рецептора-тирозинкиназы, рецептор димеризуется. Димеризация рецепторов активирует цитоплазматические домены, которые осуществляют самофосфорилирование рецептора по многим аминокислотным остаткам.
Тирозиновые протеинкиназы принимают участие в передаче сигнала в клетке путём фосфорилирования специфических остатков тирозина белков-мишеней. Специфические белки, содержащие SH2-домены или домены связывания фосфотирозина (Src, фосфолипаза Сγ), соединяются с рецептором и фосфорилируются внутриклеточным доменом. Фосфорилирование приводит к активации этих белков и инициирует пути сигнальной трансдукции. Активированные рецепторы могут взаимодействовать и с другими белками, не обладающими каталитическими активностями. Такие адапторные белки (scaffold proteins) связывают рецепторы-тирозинкиназы со следующими этапами сигнальной трансдукции, например, с каскадом МАР-киназ.
Альфа-субъединица
Основная статья: Альфа-субъединица G-белка
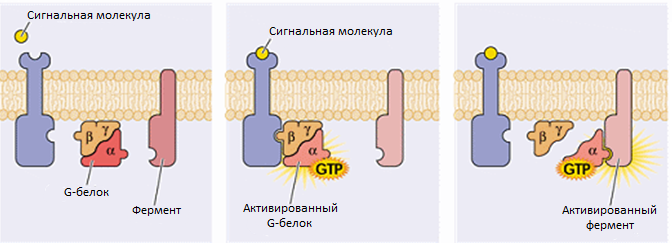
Субъединица Gα состоит из двух доменов: ГТФазного и α-спирального. Эксперименты, проведённые в 1980-х годах, показали, что очиненные субъединицы Gα могут напрямую активировать эффекторные ферменты. ГТФ-связанная форма α-субъединицы белка трансдуцина (Gt) активирует цГМФ-фосфодиэстеразу зрительных клеток палочек, а ГТФ-связанная форма α-субъединицы стимулирующего белка G (Gs) активирует гормон-чувствительную аденилатциклазу.
Существует по крайней мере 20 различных видов Gα субъединиц, распределённым по четырём разным семействам белков на основании гомологии их первичных последовательностей:
| Семейство G-белков | α-субъединица | Ген | Сигнальный каскад | G-белок-связанные метаботропные рецепторы (примеры) | Эффекты (примеры) |
|---|---|---|---|---|---|
| Семейство ингибиторных Gi | |||||
| Gi/o | Gαi, Gαo | GNAO1, GNAI1, GNAI2, GNAI3 | Ингибирование активности аденилатциклазы, открытие калиевых каналов, закрытие кальциевых каналов | Мускариновые холинорецепторы типов M2 и M4,хемокиновые рецепторы, α2-адренорецепторы, серотониновые рецепторы подтипа 5-HT1, гистаминовые рецепторы подтипа H3 и H4, дофаминовые рецепторы подтипа D2 и подобные | Сокращение гладких мышц, снижение активности нейронов |
| Семейство «зрительных» Gt | Gαt (Трансдуцин) | GNAT1, GNAT2 | Активация фосфодиэстеразы 6 | Родопсин | Передача зрительного сигнала |
| Семейство «вкус-ощущающих» Ggust | Gαgust (Густдуцин) | GNAT3 | Активация фосфодиэстеразы 6 | Вкусовые рецепторы | Передача вкусового сигнала |
| Gz | Gαz | GNAZ | Ингибирование активности аденилатциклазы | ? | Поддержание ионного баланса перилимфатических и эндолимфатических кохлеарных жидкостей. |
| Семейство стимулирующих Gs | |||||
| Семейство стимулирующих Gs | Gαs | GNAS | Активация аденилатциклазы | β-адренорецепторы; Серотониновые рецепторы подтипов 5-HT4, 5-HT6 и 5-HT7; Дофаминовые D1-подобные рецепторы, гистаминовые H2-рецепторы | Повышение частоты сердечных сокращений, расслабление гладких мышц, стимулирование активности нейронов. |
| Семейство «обонятельных» Golf | Gαolf | GNAL | Активация аденилатциклазы | обонятельные рецепторы | Передача обонятельного сигнала |
| Семейство Gq | |||||
| Семейство Gq | Gαq, Gα11, Gα14, Gα15, Gα16 | GNAQ, GNA11, GNA14, GNA15 | Активация фосфолипазы C | α1-адренорецепторы, мускариновые холинорецепторы подтипов M1, M3 и M5,гистаминовые рецепторы подтипа H1, серотониновые рецепторы подтипа 5-HT2 | Сокращение гладких мышц, ток ионов кальция |
| Семейство G12/13 | |||||
| Семейство G12/13 | Gα12, Gα13 | GNA12, GNA13 | Активация Rho семейства ГТФаз | Изменения цитоскелета клетки, сокращение гладких мышц |
Бета-гамма-димер
Основная статья: Бета-гамма-димер G-белка
Бета- и гамма-субъединицы G-белка тесно связаны друг с другом, и их называют бета-гамма-комплекс. После активации G-белок-связанного рецептора Gβγ-димер диссоциирует из связи с Gα-субъединицей после того, как Gα-субъединица произведёт гидролиз ГТФ до ГДФ.
Функция
Свободный Gβγ-димер может работать как эффекторная молекула сам по себе, может активировать другие системы вторичных посредников или может открывать и закрывать ионные каналы.
Например, Gβγ-димер, связанный с гистаминовыми H1-рецепторами, может после диссоциации активировать фосфолипазу A2, что приводит к образованию арахидоновой кислоты. В то же время Gβγ-димер, связанный с мускариновыми холинорецепторами, может непосредственно открывать G-связанные калиевые каналы внутреннего выпрямления, а Gβγ-димер, связанный с гистаминовыми H3-рецепторами, может открывать кальциевые каналы L-типа.
Функции[править | править код]
Протеинкиназа А регулирует активность многих белков фосфорилируя их. Результаты активности протеинкиназы А зависят от типа клетки:
Функции протеинкиназы А в различных типах клеток человека
| Тип клетки | Орган/система | Стимуляторы | Ингибиторы | Последствия |
|---|---|---|---|---|
| адипоциты |
|
|
||
| миоциты (скелетная мускулатура) | мускульная система |
|
||
| гепатоциты | печень |
|
|
|
| главные клетки в почках | почки |
|
|
|
| миоциты (гладкая мускулатура) | мускульная система |
|
|
Расширение кровеносных сосудов |
| Клетки почек | почки | Вазопрессин → Аргинин-вазопрессиновый рецептор 2 | стимуляция симпорта Na-K-2Cl (возможны лишь незначительные эффекты) | |
| Клетки почек | почки | Вазопрессин → Аргинин-вазопрессиновый рецептор 2 | стимуляция натриевых каналов клеток эпителия (возможны лишь незначительные эффекты) | |
| Клетки почек | почки | Вазопрессин → Аргинин-вазопрессиновый рецептор 2 |
|
|
| извитой проксимальный клеточный каналец | почки | Паратиреоидный гормон → рецептор паратиреоидного гормона | Ингибирование натрий-водородного антипорта 3 → ↓H+ секреция | |
| Юкстагломерулярные клетки | почки |
|
секреция ренина |
Функции
Протеинкиназа А регулирует активность многих белков фосфорилируя их. Результаты активности протеинкиназы А зависят от типа клетки:
Функции протеинкиназы А в различных типах клеток человека
| Тип клетки | Орган/система | Стимуляторы | Ингибиторы | Последствия |
|---|---|---|---|---|
| адипоциты |
|
|
||
| миоциты (скелетная мускулатура) | мускульная система |
|
||
| гепатоциты | печень |
|
|
|
| главные клетки в почках | почки |
|
|
|
| миоциты (гладкая мускулатура) | мускульная система |
|
|
Расширение кровеносных сосудов |
| Клетки почек | почки | Вазопрессин → Аргинин-вазопрессиновый рецептор 2 | стимуляция симпорта Na-K-2Cl (возможны лишь незначительные эффекты) | |
| Клетки почек | почки | Вазопрессин → Аргинин-вазопрессиновый рецептор 2 | стимуляция натриевых каналов клеток эпителия (возможны лишь незначительные эффекты) | |
| Клетки почек | почки | Вазопрессин → Аргинин-вазопрессиновый рецептор 2 |
|
|
| извитой проксимальный клеточный каналец | почки | Паратиреоидный гормон → рецептор паратиреоидного гормона | Ингибирование натрий-водородного антипорта 3 → ↓H+ секреция | |
| Юкстагломерулярные клетки | почки |
|
секреция ренина |
Нерецепторные тирозинкиназы
Семейство р38 MAPKs включает 4 члена (р38а, р38р, ERK6 (extracellular signal-regulated kinase 6 — киназу 6, регулируемую внеклеточными сигналами) и SAPK4 (stress-activated protein kinase — протеинкиназа, активируемая стрессом). Механизмы их активации
G-белками включают нерецепторные тирозинкиназы Btk и Src. Большая активируемая митогенами киназа ERK5 участвует в регуляции экспрессии генов (в частности, за счёт фосфорилирования транскрипционного фактора MEF2 — myocyte enhancer factor — энхансерный фактор миоцитов).
Регуляция ионных каналов G-белками
Все ионные каналы имеют общую структурную особенность: наличие поры, образуемой трансмембранными сегментами белка. Конформация белка динамически изменяется между открытым и закрытым состоянием поры. Большинство ионных каналов регулируется нейромедиаторами и гормонами через Рц, сопряжённые с G-белками опосредованно (через вторые посредники) или прямо. Прямое взаимодействие G-белков с ионными каналами показано для активируемых G-белками К+-каналов входящего выпрямления
(GIPvKs) и для некоторых потенциалзависимых Са2+ каналов (voltage-activated Са2+ channels, Са2+у).
GIRKs опосредуют постсинаптическое ингибиторное действие ряда нейромедиаторов (дофамин, соматостатин, опиоиды и др.) в нейронах и в значительной мере определяют хронотропное парасимпатическое действие на сердце. Эффект опосредуется ру-СЕ G-белков (GPy). Показано, что в каждой СЕ GIRK имеется по 3 Gpy-связывающих сегмента (рис. 5.18А, утолщенные сегменты внутриклеточных N- и С-концов), в результате на канал приходится до 12 таких сегментов, обеспечивающих связывание 4 димеров Ру тет-рамерным GIRK (тетрамерные GIRKs состоят из 4 типов СЕ, GIRK1—4. Функциональными каналами могут быть гомотетрамеры GIRK2 и GIRK4 или гетеротетрамеры GIRK1/2, GIRK1/3, GIRK2/3 и GIRK1/4. Основой структуры каналов служат трансмембранные а-спирали Ml и М2, а также возвратная спиральная Р-петля, служащие избирательным фильтром для ионов.) Способностью активировать GIRK обладают все исследованные комбинации G(3 и Gy. В то же время в нейронах и сердце только чувствительные к коклюшному токсину G-белки (т.е. содержащие Gai/o) активируют GIRK.
Регуляция
Рецепторы, связанные с G-белками теряют чувствительность после длительной экспозиции со своими лигандами. Различают две формы потери чувствительности (десенситизации): 1) гомологичную, при которой сокращается число активированных рецепторов; и 2) гетерологическую, при которой активированный рецептор вызывает сокращение числа рецепторов других типов. Ключевой реакцией подобного сокращения числа рецепторов является фосфорилирование внутриклеточного (или, что то же, цитоплазматического) домена рецептора протеинкиназами.
Фосфорилирование цАМФ-зависимыми протеинкиназами
цАМФ-зависимые киназы (протеинкиназа А) активируются цепью сигналов с G-белка (который был активирован рецептором) посредством аденилатциклазы и цАМФ. По механизму обратной связи эти активированные киназы фосфорилируют рецептор. Чем дольше рецептор остаётся активным, тем больше киназ активируется, тем больше рецепторов фосфорилируется.
Фосфорилирование GRK-киназами
Киназы рецепторов, связанных с G-белками (GRK-киназы) — это протеинкиназы, фосфорилирующие лишь активные рецепторы, связанные с G-белками.
Фосфорилирование рецептора может иметь такие последствия:
- Транслокация: Рецептор, заодно с частью окружающей его мембраны, захватывается внутрь клетки, где дефосфорилируется при кислых значениях внутри везикул среды и возвращается обратно. Этот механизм используется для регуляции при долговременном воздействии, например, гормонов, позволяя возвращение чувствительности (ресенситизацию) после её потери. Иначе, рецептор может претерпеть лизосомальное расщепление или остаться интернализованным, участвуя, как предполагается, в инициации сигналов, природа которых зависит от внутриклеточного расположения интернализованной везикулы.
- Связывание аррестина: Фосфорилированный рецептор может связаться с молекулами аррестина, которые не допустят его связывания с G-белками (и активации их), эффективно выключая рецептор на короткое время. Этот механизм используется, например, в родопсине клеток сетчатки для компенсации воздействия яркого света.
Механизм
Рецепторы, сопряжённые с G-белком, активируются внешним сигналом в виде лиганда. Это создаёт конформационные изменения в рецепторе, вызывающие активацию G-белка. Дальнейший эффект зависит от типа G-белка.
Связывание лиганда
μ-Опиоидный рецептор со своим агонистом
Семейство GPCR включает рецепторы органов чувств (реагирующие, например, на свет или молекулы пахучих веществ); аденозина, бомбезина, брадикинина, эндотелина, γ-аминомасляной кислоты (ГАМК), фактора роста гепатоцитов, меланокортинов, нейропептида Y, опиоидных пептидов, опсинов, соматостатина, тахикининов и вазопрессина; биогенных аминов (например, дофамина, адреналина, норадреналина, гистамина, глутамата, глюкагона, ацетилхолина и серотонина); хемокинов; липидных медиаторов воспаления (напр., простагландинов, тромбоксанов, простациклинов, фактора активации лейкоцитов и лейкотриенов); и пептидных гормонов (напр., кальцитонина, C5a анафилотоксина, фолликулостимулирующего гормона (ФСГ), гонадолиберина, нейрокинина, тиролиберина и окситоцина). Существует также GPCR, лиганды и стимулы для которых ещё не определены, их называют рецепторами-сиротами, или орфановыми рецепторами (orphan receptors).
В то время как в других типах изученных рецепторов лиганды связываются на внешней стороне мембраны, лиганды GPCR обычно связываются в трансмембранном домене.
Конформационные изменения
Передача сигнала рецептором через мембрану во всех деталях ещё не понята. Известно, что неактивный G-белок связан с рецептором в его неактивном состоянии. Как только лиганд распознан, рецептор меняет конформацию и таким образом механически активирует G-белок, который отсоединяется от рецептора. Теперь рецептор может или активировать следующий G-белок, или переключиться обратно в своё неактивное состояние. Хотя это и слишком упрощённые представления, они достаточны для описания основных событий.
Считается, что молекула рецептора существует в конформационном равновесии между активным и неактивным состояниями. Связывание лиганда может сдвинуть равновесие в сторону активного состояния. Существуют три типа лигандов: агонисты смещают это равновесие в сторону активного состояния; обратные агонисты — в сторону неактивного состояния; и нейтральные антагонисты не влияют на равновесие. Однако в настоящее время ещё точно не известно, чем же активное и неактивное состояние отличаются друг от друга.
Активация G-белка
Если рецептор в активном состоянии встречается с G-белком, то может активировать его. Активированные G-белки связаны с ГТФ.
Дальнейшая передача сигнала зависит от типа G-белка. Фермент аденилатциклаза является одним из клеточных белков, которые могут регулироваться G-белком, а именно, его активированной субъединицей G<sub>s</sub>. Активация аденилатциклазы начинается, когда та связывается с субъединицей активированного G-белка, а заканчивается, когда G-белок гидролизует ГТФ и возвращается в ГДФ-связанное состояние, при котором все его субъединицы соединены в единую молекулу с четвертичной структурой.
Необходимость димеризации
Мутация, блокирующая димеризацию этого Рц, подавляет и его активацию лигандом. Лиганды обычно стимулируют олигомеризацию собственных Рц. Димеризация Рц может быть и конститутивной, т.е. не зависящей от лиганда (например, в случае сенсора кальция).
Необходимость димеризации для активации Рц, по-видимому, не является универсальным правилом. Например, степень димеризации Рц 8 опиоидов и олигомеризации Рц ТТГ снижается в присутствии агониста. Определённую роль в проведении сигнала может играть гетеродимеризация между близкородственными Рц. Так, Рц ГАМК (GABAB Pv2) способствует созреванию формы Рц GABAB R1 за счёт образования с ним гетеродимеров. Гетеродимер из опи-оидных Рц 5 и к приобретает свойства, отличные от свойств составляющих его Рц. Гетеродимеризация Рц соматостатина sst2A и sst3 ведёт к инактивации sst3 при одновременном снижении скорости десенситизации sst2A. Аналогичную супрессорную функцию выполняет Рц ангиотензина 2 по отношению к партнёру по гетеро-димеризации — Рц ангиотензина 1. В то же время образование димеров между sst2A и ц-Рц опиоидов не влияет на способность этих Рц связывать лиганды и проводить сигнал. Однако лиганд sst2A индуцирует фосфорилирование, интернализацию и десенситизацию не только своего Рц, но и партнёра по гетеродимеризации. Практически симметрично действует лиганд ц-Рц опиоидов. Ещё один тип последствий наблюдается при гетероолигомеризации Рц соматостатина sst5 и Рц дофамина D2R. Такой олигомер оказывается функционально более активным, чем его составляющие.
Таким образом, гомо- и олигомеризация Рц данного класса может иметь разные последствия для проведения гормональных сигналов. Обнаружена и патогенетическая роль гетеродимеризации: при преэклампсии резко увеличивается образование гетеродимеров между Рц ангиотензина 1 для вазоконстриктора ангиотензина II и Рц В(2) для вазорелаксанта брадикинина; такие гетеродимеры обеспечивают гиперчувствительность к гипертензивному действию ангиотензина, усугубляя развитие заболевания.
Гистидин — специфичные протеинкиназы
Гистидиновые киназы найдены в прокариотах и по своей структуре отличаются от других известных протеинкиназ. У прокариот гистидин-специфичные протеинкиназы работают как часть двухкомпонентной системы сигнальной трансдукции. В ходе фосфорилирования неорганический фосфат отщепляется от АТФ и присоединяется к собственному остатку гистидина, а затем переносится на остаток аспартата белка-мишени. Фосфорилирование аспартата приводит к дальнейшей передаче сигнала.
Гистидиновые киназы широко распространены среди прокариот, растений и грибов. Фермент пируватдегидрогеназа животных, относящийся к семейству протеинкиназ, структурно повторяет гистидиновые киназы, но фосфорилирует остатки серина, и, возможно, не использует гистидин-фосфатный интермедиат.