Анаэробный гликолиз
Содержание:
Разница между циклом Кребса и гликолизом
Определение
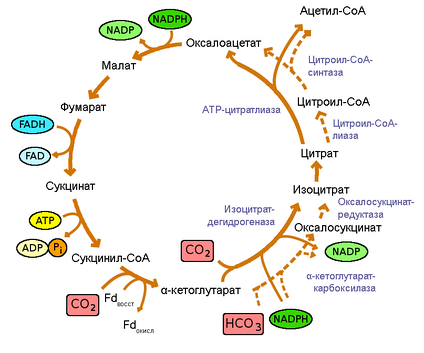
Цикл Кребса: Цикл Кребса, также известный как цикл лимонной кислоты или цикл трикарбоновых кислот (цикл ТСА), относится к серии химических реакций, в которых пируват превращается в ацетил-КоА и полностью окисляется до диоксида углерода и воды.
Гликолиз: Гликолиз относится к серии химических реакций, в которых молекула глюкозы превращается в две молекулы пировиноградной кислоты.
шаг
Цикл Кребса: Цикл Кребса является вторым этапом клеточного дыхания.
Гликолиз: Гликолиз — это первая стадия клеточного дыхания.
Цикл Кребса: Цикл Кребса происходит внутри митохондрий эукариот.
Гликолиз: Гликолиз происходит в цитоплазме.
Аэробное / анаэробное дыхание
Цикл Кребса: Цикл Кребса происходит только при аэробном дыхании.
Гликолиз: Гликолиз происходит как при аэробном, так и при анаэробном дыхании.
Процесс
Цикл Кребса: Цикл Кребса участвует в полном окислении пирувата в углекислый газ и воду.
Гликолиз: Гликолиз участвует в разложении глюкозы на две молекулы пирувата.
Цикл Кребса: Цикл Кребса является циклическим процессом.
Гликолиз: Гликолиз — это линейный процесс.
Конечный продукт
Цикл Кребса: Конечным продуктом цикла Кребса является неорганическое углеродное вещество.
Гликолиз: Конечным продуктом гликолиза является органическое вещество.
Цикл Кребса: Цикл Кребса не потребляет АТФ.
Гликолиз: Гликолиз потребляет две молекулы АТФ.
Чистая прибыль
Цикл Кребса: Цикл Кребса производит шесть молекул NADH и две FADH2 молекулы.
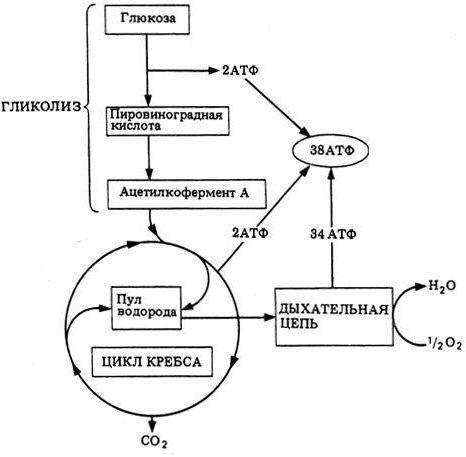
Гликолиз: Гликолиз производит две молекулы пирувата, две молекулы АТФ, две молекулы НАДН.
Чистая прибыль от энергии
Цикл Кребса: Чистый прирост энергии цикла Кребса равен 24 молекулам АТФ.
Гликолиз: Чистый прирост энергии гликолиза равен 8 молекулам АТФ.
Углекислый газ
Цикл Кребса: Углекислый газ выделяется в процессе цикла Кребса.
Гликолиз: В процессе гликолиза не выделяется углекислый газ.
Окислительного фосфорилирования
Цикл Кребса: Цикл Кребса связан с окислительным фосфорилированием.
Гликолиз: Гликолиз не связан с окислительным фосфорилированием.
кислород
Цикл Кребса: Цикл Кребса использует кислород в качестве конечного окислителя.
Гликолиз: Гликолиз не требует кислорода.
Заключение
Цикл Кребса и гликолиз — два этапа клеточного дыхания. Цикл Кребса происходит только при аэробном дыхании. Гликолиз характерен как для аэробного, так и для анаэробного дыхания. Цикл Кребса следует за гликолизом. Во время гликолиза две молекулы пирувата образуются из молекулы глюкозы. Эти молекулы пирувата полностью окисляются в углекислый газ и воду во время цикла Кребса. Основное различие между циклом Кребса и гликолизом заключается в исходных материалах, механизме и конечных продуктах каждого этапа.
Значение гликолиза
Гликолиз — это уникальный, однако не единственный вид окисления глюкозы в организме, клетке как прокариотов, так и эукариотов. Ферменты гликолиза являются водорастворимыми. Реакция гликолиза в некоторых тканях и клетках может происходить только таким образом, например, в мозгу и клетках нефронов печени. Другие способы окисления глюкозы в этих органах не используются. Однако не везде функции гликолиза одинаковы. Например, жировые ткани и печени в процессе пищеварения добывают необходимые субстраты из глюкозы для синтеза жиров. Многие растения используют гликолиз как способ добычи основной части энергии.
Анаэробный гликолиз глюкозы в эритроцитах, 2,3-БФГ и эффект Бора[править | править код]
Рис. 18.1. Анаэробный гликолиз в эритроцитах
Рис. 18.2. Образование 2,3-бисфосфоглицерата в эритроцитах
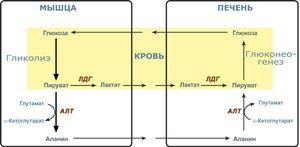
Эритроциты транспортируют большое количество кислорода, которым снабжают все органы человека. По иронии судьбы сами они не могут использовать этот кислород. Источником энергии для эритроцитов служит глюкоза, при окислении которой в ходе анаэробного гликолиза в эритроцитах образуется АТФ (рис. 18.1). Аэробное окисление глюкозы в эритроцитах невозможно, так как в них отсутствуют митохондрии и вместе с ними все ферменты цикла Кребса. Кроме того, в них отсутствуют также ферменты, необходимые для окисления жирных кислот и использования кетоновых тел.
Функция эритроцитов — транспорт кислорода ко всем органам и тканям организма. Гемоглобин эритроцитов прочно связывается с кислородом, образуя оксигемоглобин. Однако в периферических тканях эритроциты должны отдать этот кислород другим клеткам. Это осуществляется благодаря явлению, известному под названием эффекта Бора. Эффект Бора создается благодаря двум факторам: протонам и 2,3-бисфосфоглицерату (рис. 18.2).
Протоны вытесняют кислород из оксигемоглобина
Работающим мышцам необходим АТФ, и поэтому в них интенсивно функционирует цикл Кребса. В цикле Кребса образуется диоксид углерода, который проникает в эритроциты и реагирует с водой, образуя угольную кислоту (эту реакцию катализирует карбоангидраза). Угольная кислота самопроизвольно диссоциирует, образуя бикарбонат и протон, что приводит к местному возрастанию концентрации протонов (Н+), т.е. понижению pH. Протоны высвобождают кислород из гемоглобина, и кислород диффундирует из эритроцитов в периферические ткани. Здесь он связывается с миоглобином и переносит кислород в дыхательную цепь, где он используется для синтеза АТФ путем окислительного фосфорилирования.
Высвобождение кислорода в периферических тканях: 2,3-бисфосфоглицерат (2,3-БФГ) стабилизирует структуру дезоксигемоглобина. Помимо протонов, в создании эффекта Бора принимает участие 2,3-бисфосфоглицерат (2.3-БФГ) (рис. 18.2). В медицинской литературе распространено и другое название этого вещества — 2,3-дифосфоглицерат (2,3-ДФГ). 2.3-БФГ образуется в анаэробных условиях в эритроцитах. Процесс образования 2,3-БФГ происходит в дополнительной реакции гликолиза, получившей название
2,3-БФГ-шунта (шунт Рапопорта-Люберинга) (рис. 18.2). В периферических тканях молекула 2,3-БФГ связывается с дезоксигемоглобином и стабилизирует его структуру, не позволяя ему захватывать кислород от соседней молекулы оксигемоглобина.
Связывание гемоглобина с кислородом в легких. Эритроциты переносят дезоксигемоглобин и связанный с ним СО2 в легкие. Поскольку в легких имеет место высокое парциальное давление кислорода, он вытесняет С02 из гемоглобина, и С02 выходит из легких при выдохе. Кислород связывается с гемоглобином, образуя оксигемоглобин, 2,3-БФГ вытесняется, и эритроциты переносят к периферическим тканям следующую порцию кислорода.
Гликолиз в раковых клетках
1928 Отто Варбург обнаружил, что в раковых клетках почти всех типов гликолиз и поглощение глюкозы происходит примерно в 10 раз интенсивнее, чем у здоровых, даже в присутствии больших концентраций кислорода. Эффект Варбурга стал основой для разработки нескольких методов выявления и лечения рака.
Все раковые клетки, по крайней мере на начальных этапах развития опухоли растут в условиях гипоксии, то есть недостатка кислорода, из-за отсутствия сетки капилляров. Если они расположены на расстоянии более 100-200 мкм от ближайшей кровеносного сосуда, то должны полагаться только на гликолиз без дальнейшего окисления пирувата для получения АТФ. Йомвирно, что почти во всех раковых клетках в процессе злокачественной трансформации происходят следующие изменения: переход на получение энергии только путем гликолиза и приспособления к условиям повышенной кислотности, возникающих вследствие выделения молочной кислоты в межклеточную жидкость. Чем более агрессивная опухоль, тем быстрее в ней происходит гликолиз.
Приспособление раковых клеток к недостатку кислорода во многом происходит благодаря транскрипционных факторов индуцированном гипоксией (англ. Hypoxia-inducible transcription factor, HIF-1), который стимулирует повышение экспрессии как минимум восьми генов гликолитических ферментов, а также транспортеров глюкозы GLUT1 и GLUT3, активность которых не зависит от инсулина. Еще одним ефекторм HIF-1 является выделение клетками васкулярного эндотелиального фактора роста (англ. Vascular endothelial growth factor), что стимулирует образование кровеносных сосудов в опухоли. HIF-1 также выделяется мышцами во время тренировок, предусматривающие большую интенсивность нагрузки, в этом случае он имеет аналогичный эффект: усиливает способность к анаэробного синтеза АТФ и стимулирует рост капилляров.
В некоторых случаях повышенная интенсивность гликолиза может быть использована для нахождения местоположения опухоли в организме с помощью позитрон-эмиссионной томографии (ПЭТ). Пациенту в кровь вводят аналог глюкозы 2-флюоро-2-дезоксиглюкозу (ФДГ), меченый изотопом 18 F. Это вещество поглощается клетками и является субстратом для первого фермента гликолиза — гексокиназы, однако не может быть преобразована фосфоглюкоизмеразою, поэтому накапливается в цитоплазме. Скорость накопления зависит от интенсивности захвата аналога глюкозы и его фосфорилирования, оба процесса значительно быстрее происходят в раковых клетках, чем в здоровых. При распаде 18 F выделяются позитроны, которые фиксируются специальными сенсорами.
Особенности катаболизма глюкозы в злокачественных опухолях используются не только для диагностики, но и для разработки новых противораковых препаратов, среди которых: ингибиторы гексокиназы (2-дезоксиглюкоза, лонидамин, 3-бромпируват), Иматиниб (Gleevec), подавляющее определенную тирозинкиназы, которая стимулирует синтез гексокиназы, и другие.
Определение
Анаэробный гликолиз – ферментативный процесс, включающий последовательное преобразование виноградного сахара для получения энергии. Реакция строится на обратимом превращении пируватов в лактат посредством катализа лактатдегидрогеназой. С ее помощью органы человека используют аденозинтрифосфат для получения сил во время тренинга. Содержание этого компонента удваивается и удерживается на таком уровне около 20 секунд, что позволяет успешно закончить подход. Основная особенность происходящей реакции заключается в отсутствии участия O₂ и побочном образовании лактата.
Аэробный гликолиз – это схожее явление, в ходе которого также происходит разложение глюкозы с получением АДФ, обеспечивающее обмен энергии в организме. В отличие от предыдущей разновидности получения ресурсов реакция протекает с атомами кислорода и водорода. В результате побочных компонентов образуется углекислый газ и вода.
В обоих случаях энергетический выброс дает силы человеку справиться с физической нагрузкой в течение определенного времени.
Локализация[править]
В клетках эукариотических организмов десять ферментов, катализирующих распад глюкозы до ПВК, находятся в цитозоле, все остальные ферменты, имеющие отношение к энергетическому обмену, — в митохондриях. Поступление глюкозы в клетку осуществляется двумя путями: натрий-зависимый ко-транспорт (преимущественно для энтероцитов и эпителия почечных канальцев) и облегчённая диффузия глюкозы с помощью белков-переносчиков. Работа этих белков-транспортёров контролируется гормонами и, в первую очередь, инсулином. Сильнее всего инсулин стимулирует транспорт глюкозы в мышцах и жировой ткани.
Общий обзор
| Внешние изображения |
|---|
Глюконеогенез происходит у животных, растений, грибов и микроорганизмов. Его реакции одинаковы для всех тканей и биологических видов. Важными предшественниками глюкозы у животных выступают трёхуглеродные соединения, такие как лактат, пируват, глицерол, а также некоторые аминокислоты. У млекопитающих глюконеогенез происходит главным образом в печени, в меньшей степени — в корковом слое почек и эпителиальных клетках, выстилающих тонкую кишку. Образованная в ходе глюконеогенеза глюкоза уходит в кровь, откуда доставляется к другим тканям. После интенсивной физической работы лактат, образовавшийся при анаэробном гликолизе в скелетных мышцах, возвращается в печень и превращается там в глюкозу, которая снова поступает в мышцы или превращается в гликоген (этот круговорот известен как цикл Кори). У проростков растений запасённые в семени жиры и белки превращаются, в том числе и через глюконеогенез, в дисахарид сахарозу, который транспортируется по всему развивающемуся растению. Глюкоза и её производные служат предшественниками для синтеза растительной клеточной стенки, нуклеотидов, коферментов и многих других жизненно важных метаболитов. У многих микроорганизмов глюконеогенез начинается с простых органических соединений, содержащих два или три атома углерода, например, ацетата, лактата и пропионата, которые содержатся в питательной среде.
Хотя реакции глюконеогенеза одинаковы у всех организмов, соседние метаболические пути и регуляторные пути глюконеогенеза отличаются у различных видов и в различных тканях. В этой статье рассмотрены особенности глюконеогенеза млекопитающих; о механизмах синтеза глюкозы растениями из первичных продуктов фотосинтеза см. Фотосинтез.
Глюконеогенез и гликолиз не являются полностью идентичными процессами, протекающими в противоположных направлениях, хотя несколько стадий являются общими для обоих процессов: 7 из 10 ферментативных реакций глюконеогенеза обратны соответствующим реакциям гликолиза. Однако 3 реакции гликолиза необратимы in vivo и не могут использоваться в глюконеогенезе: образование глюкозо-6-фосфата из глюкозы под действием фермента гексокиназы, фосфорилирование фруктозо-6-фосфата до фруктозо-1,6-бифосфата фосфофруктокиназой-1 (PFK-1), а также превращение фосфоенолпирувата в пируват под действием . В клеточных условиях эти реакции имеют большое отрицательное изменение энергии Гиббса, в то время как другие реакции гликолиза имеют ΔG около 0. При глюконеогенезе три необратимые стадии гликолиза заменены «обходными» реакциями, катализируемыми другими ферментами, и эти реакции также очень экзергоничны и потому необратимы. Таким образом, в клетках как гликолиз, так и глюконеогенез являются необратимыми процессами. У животных гликолиз происходит только в цитозоле, как и большая часть реакций глюконеогенеза, хотя некоторые его реакции происходят в митохондриях и эндоплазматическом ретикулуме. Это даёт возможность для их координированной и взаимно обратной регуляции. Регуляторные механизмы, различающиеся у гликолиза и глюконеогенеза, действуют на ферментативные реакции, уникальные для каждого процесса.
Ниже представлена схема реакций глюконеогенеза:
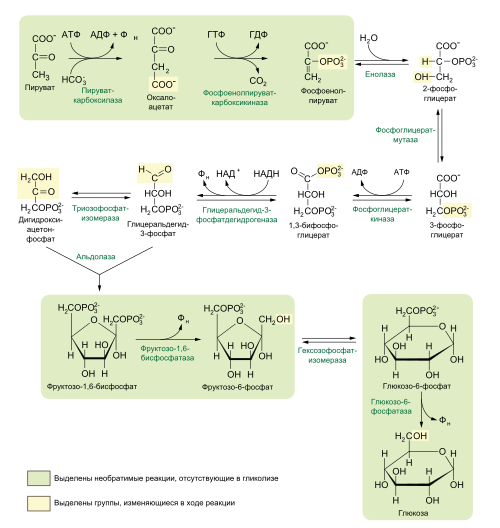
Путь[править]
Первой реакцией гликолиза является фосфорилирование молекулы глюкозы, происходящее при участии тканеспецефичного фермента гексокиназы с затратой энергии 1 молекулы АТФ; образуется активная форма глюкозы — глюкозо-6-фосфат (Г-6-Ф):
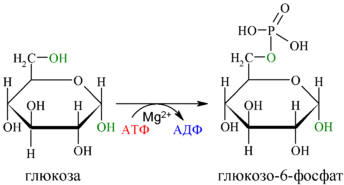
Для протекания реакции необходимо наличие в среде ионов Mg2+, с которым комплексно связывается молекула АТФ. Эта реакция необратима и является первой ключевой реакцией гликолиза.
Фосфорилирование глюкозы преследует две цели: во-первых, из-за того что плазматическая мембрана, проницаемая для нейтральной молекулы глюкозы, не пропускает отрицательно заряженные молекулы Г-6-Ф, фосфорилированная глюкоза оказывается запертой внутри клетки. Во-вторых, при фосфорилировании глюкоза переводится в активную форму, способную участвовать в биохимических реакциях и включаться в метаболические циклы. Фосфорилирование глюкозы — это единственная реакция в организме, в которой глюкоза участвует как таковая.
Печёночный изофермент гексокиназы — глюкокиназа — имеет важное значение в регуляции уровня глюкозы в крови.
В следующей реакции (2) ферментом фосфоглюкоизомеразой Г-6-Ф превращается во фруктозо-6-фосфат (Ф-6-Ф):
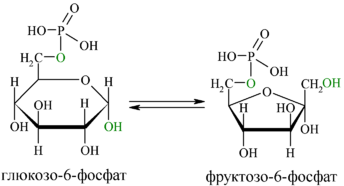
Энергия для этой реакции не требуется, и реакция является полностью обратимой. На данном этапе в процесс гликолиза может также включаться путём фосфорилирования и фруктоза.
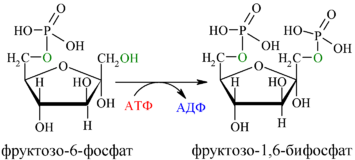
Далее почти сразу друг за другом следуют две реакции: необратимое фосфорилирование фруктозо-6-фосфата (3) и обратимое альдольное расщепление образовавшегося фруктозо-1,6-бифосфата (Ф-1,6-бФ) на две триозы (4).
Фосфорилирование Ф-6-Ф осуществляется фосфофруктокиназой с затратой энергии ещё одной молекулы АТФ; это вторая ключевая реакция гликолиза, её регуляция определяет интенсивность гликолиза в целом.
Альдольное расщепление Ф-1,6-бФ происходит под действием альдолазы фруктозо-1,6-бифосфата:
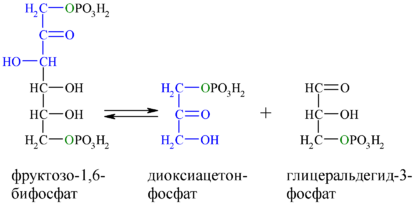
В результате четвёртой реакции образуются дигидроксиацетонфосфат и глицеральдегид-3-фосфат, причём первый почти сразу под действием фосфотриозоизомеразы переходит во второй (5), который и участвует в дальнейших превращениях:
Каждая молекула глицеральдегидфосфата окисляется НАД+ в присутствии дегидрогеназы глицеральдегидфосфата до 1,3-дифосфоглицерата (6):
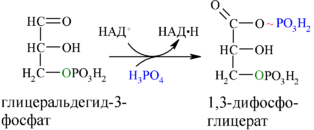
Далее с 1,3-дифосфоглицерата, содержащего макроэргическую связь в 1 положении, ферментом фосфоглицераткиназой на молекулу АДФ переносится остаток фосфорной кислоты (реакция 7) — образуется молекула АТФ:
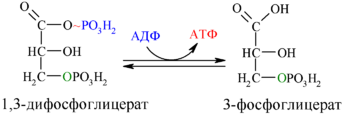
Это первая реакция субстратного фосфорилирования. С этого момента процесс расщепления глюкозы перестаёт быть убыточным в энергетическом плане, так как энергетические затраты первого этапа оказываются компенсированными: синтезируются 2 молекулы АТФ (по одной на каждый 1,3-дифосфоглицерат) вместо двух потраченных в реакциях 1 и 3. Для протекания данной реакции требуется присутствие в цитозоле АДФ, то есть при избытке в клетке АТФ (и недостатке АДФ) её скорость снижается. Поскольку АТФ, не подвергающийся метаболизму, в клетке не депонируется а просто разрушается, то эта реакция является важным регулятором гликолиза.
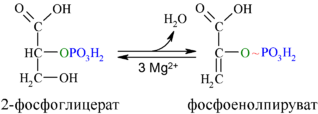
Затем последовательно: фосфоглицеролмутаза образует 2-фосфоглицерат (8):
Енолаза образует фосфоенолпируват (9):
И наконец происходит вторая реакция субстратного фосфорилирования АДФ с образованием енольной формы пирувата и АТФ (10):
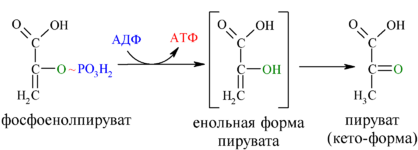
Реакция протекает под действием пируваткиназы. Это последняя ключевая реакция гликолиза. Изомеризация енольной формы пирувата в пируват происходит неферментативно.
С момента образования Ф-1,6-бФ с выделением энергии протекают только реакции 7 и 10, в которых и происходит к субстратное фосфорилировнаие АДФ.