Эндорфины (эндогенные опиоиды)
Содержание:
Формы и действия рецепторовПравить
Как потенциал действия перемещается вдоль аксона, происходит изменение полярности через мембраны. Отель na+ и K+ охраняющая ионные каналы, открываются и закрываются как мембраны достигает порогового потенциала, в ответ на сигнал от другого нейрона. В начале потенциала действия на Nа+ каналов и na+ движется внутрь аксона, вызывая деполяризацию. Реполяризация происходит, когда на K+ каналы и K+ выходит из аксона. Это создает изменение полярности между вне клетки и внутри. Импульс проходит вниз по аксону в одном направлении, в терминале аксона, где это сигналы касаются других нейронов.
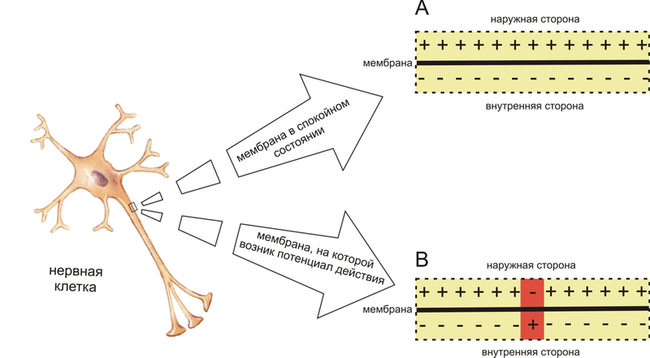
Рис. 1. Схема распределения зарядов по разные стороны мембраны возбудимой клетки в спокойном состоянии (A) и при возникновении потенциала действия (B) (см. объяснения в тексте Потенциал действия).
Трансмембранное место — receptor: E = extracellular ; место I = intracellular; мембрана P = plasma. В зависит от их функций и лигандов, которые могут идентифицировать несколько типов рецепторов (см. рис.1t):
- Некоторые белки рецептора — периферийные мембранные белки.
- Много гормонов и рецепторов медиатора — трансмембранные белки: трансмембранные рецепторы вложены в двойной слой фосфолипида мембран ячейки, которые позволяют активацию троп трансдукции сигнала в ответ на активацию обязательной молекулой, или лигандом.
- Рецепторы Metabotropic соединены с белками Г и затрагивают ячейку косвенно через ферменты, которые управляют каналами иона.
- Рецепторы Ionotropic (также известные как каналы иона лиганда-gated) содержат центральную пору, которая открывается в ответ на закрепление лиганда.
- Другой главный класс рецепторов — внутриклеточные белки, типа тех, которые для стероида и intracrine гормональных рецепторов пептида. Эти рецепторы часто могут входить в ядро ячейки и модулировать генное выражение в ответ на активацию лигандом.
Мембранные рецепторы изолированы от мембран ячейки в соответствии со сложными процедурами извлечения, используя растворители, моющие средства, и/или очистка близости.
Стимулами для разных рецепторов могут служить свет, механическая деформация — изменение размеров, химические вещества, изменения температуры, а также изменения электрического и магнитного поля. В рецепторных клетках (будь то непостредственно нервные окончания или специализированные клетки) соответствующий сигнал изменяет конформацию чувствительных молекул-клеточных рецепторов, что приводит к изменению активности мембранных ионных рецепторов и к изменению мембранного потенциала клетки. Если воспринимающей клеткой является непосредственно нервное окончание (так называемые первичные рецепторы), то происходит деполяризация мембраны с последующей генерацией нервного импульса. Специализированные рецепторные клетки вторичных рецепторов могут как де-, так и гиперполяризоваться. В последнем случае изменение мембранного потенциала ведет к уменьшению секреции тормозного медиатора, действующего на нервное окончание и, в конечном счете, все равно к генерации нервного импульса. Напаример, вызвать генерацию нервного импульса может фотон, попавший на мембрану клетки находящейся в фоточувствительном слое сетчатки.
В качестве клеточных рецепторных молекул могут выступать либо механо-, термо- и хемочувствительные ионные каналы, либо специализированные G-белки (как в клетках сетчатки). В первом случае открытие каналов непосредственно изменяет мембранный потенциал (механочувствительные каналы в тельцах Пачини), во втором случае запускается каскад внутриклеточных реакций трансдукции сигнала, что ведет в конечном счете к открытию каналов и изменению потенциала на мембране.
История
Фридрих Сертюрнер, немецкий аптекарь, впервые выделивший морфин из опиума
Флакон героина компании Bayer, начало XX в.
Опиум применялся человеком ещё более 4000 лет назад. В Минойской цивилизации почиталась богиня, увенчанная короной из коробочек опийного мака. Более поздние центры культивации опийного мака были обнаружены недалеко от Коринфа (современная Греция) и Афьона (современная Турция). Оттуда культивация мака распространилась на восток. До середины XVII века опиум применялся практически исключительно для обезболивания (в противоположность наркотическому применению).
Курение опиума в рекреационных целях получило распространение в Китае во второй половине XVII века. С конца XVIII века Британская Ост-Индская компания, пользуясь монопольными привилегиями, ввозила огромные количества опиума в Китай, что впоследствии привело к Опиумным войнам.
В 1804 г. немецкий аптекарь Фридрих Сертюрнер впервые извлёк из опиума его основное действующее вещество, названное им «морфием» (современное название морфин было предложено Гей-Люссаком). В 1898 г. в медицинскую практику вошли этилморфин и героин, полусинтетические производные морфина. Первый полностью синтетический опиоид, петидин (меперидин), был синтезирован в Германии в 1937 г., немного позднее был синтезирован метадон. В СССР использовалось производное петидина, тримеперидин (промедол). Фентанил был впервые синтезирован в Бельгии в конце 1950-х годов.
Патология
Мутация A118G (замена аденина на гуанин в экзоне 1), которая приводит к замещению аспарагина в позиции 40 на аспартат (N40D) — наиболее частая мутация, приводящая к изменению генного продукта µ-опиоидного рецептора человека. Предполагают, что пациентам с онкологическими заболеваниями, гомозиготным по варианту A118G, требуется более высокая доза морфина при длительном лечении болевого синдрома. Также внутривенное введение морфина, контролируемое пациентом, после тотальной гистерэктомии было значительно больше у женщин, гомозиготных по варианту A118G, чем у других пациенток. Некоторые формы мутаций δ-опиоидных рецепторов приводят к постоянной активации рецептора.
Патология
Мутация A118G (замена аденина на гуанин в экзоне 1), которая приводит к замещению аспарагина в позиции 40 на аспартат (N40D) — наиболее частая мутация, приводящая к изменению генного продукта µ-опиоидного рецептора человека. Предполагают, что пациентам с онкологическими заболеваниями, гомозиготным по варианту A118G, требуется более высокая доза морфина при длительном лечении болевого синдрома. Также внутривенное введение морфина, контролируемое пациентом, после тотальной гистерэктомии было значительно больше у женщин, гомозиготных по варианту A118G, чем у других пациенток. Некоторые формы мутаций δ-опиоидных рецепторов приводят к постоянной активации рецептора.
Примечания[править | править код]
- Bjorn Knollmann; Laurence Brunton; Chabner, Bruce. Goodman and Gilman’s Pharmacological Basis of Therapeutics, Twelfth Edition (SET2) (Pharmacologic Basis of Therapeutics (Goodman & Gilman)) Chapter 21. Opioid Analgesics (англ.). — McGraw-Hill Education, 2010. — ISBN 0-07-162442-2.
- ↑ Ronald D. Miller MD, Lars I. Eriksson, Lee A. Fleisher MD, Jeanine P. Wiener-Kronish MD, William L. Young. Miller’s Anesthesia. Глава «Opioids». — Churchill Livingstone, 2009. — 3312 с. — ISBN 978-0443069598.
- ↑ Norton Williams; Norman Calvey. Principles and Practice of Pharmacology for Anaesthetists. — Wiley-Blackwell, 2008. — 357 с. — ISBN 978-0632056057.
- ↑ Stein C, Schäfer M, Machelska H (2003) Attacking pain at its source: new perspectives on opioids. Nature Med;9(8):1003-1008. doi:10.1038/nm908.
- ↑ Fine, Perry G.; Russell K. Portenoy. // A Clinical Guide to Opioid Analgesia (неопр.). — McGraw-Hill Education, 2004.
- ↑
- Anil Aggrawal. . BLTC Research (1 мая 1995). Дата обращения 21 марта 2008.
- Lord JA, Waterfield AA, Hughes J, Kosterlitz HW. Nature. 1977; 267:495-499.
- Lemke, Thomas L.; Williams, David H.; Foye, William O. Opioid Analgesics; Fries, DS // Foye’s principles of medicinal chemistry (неопр.). — Hagerstown, MD: Lippincott Williams & Wilkins (англ.)русск., 2002. — ISBN 0-683-30737-1.
- Girdlestone, D. Opioid receptors; Cox BM, Chavkin C, Christie MJ, Civelli O, Evans C, Hamon MD, et al. // The IUPHAR Compendium of Receptor Characterization and Classification (англ.). — 2nd. — London: IUPHAR Media, 2000. — P. 321—333.
- Харкевич Д.А. Фармакология. — Москва: ГЭОТАР-Медиа, 2006. — 736 с. — ISBN 5-9704-0264-8.
- Bertram G. Katzung. Basic & clinical pharmacology. 11th edition. — McGraw-Hill Medical, 2009. — 1200 с. — ISBN 0071604057.
- Бунятян, Мизиков. Рациональная фармакоанестезиология. — Москва: Литтерра, 2003. — 795 с. — 7000 экз. — ISBN 5-98216-040-7.
Виды опиоидных рецепторов[править | править код]
В настоящее время различают четыре основные группы опиоидных рецепторов, каждая из которых подразделяется ещё на несколько подтипов:
| Рецептор | Подтип | Расположение | Функция |
|---|---|---|---|
| мю (μ) MOP | μ1, μ2, μ3 |
|
μ1
анальгезия; физическая зависимость : μ2:
μ3: неизвестна |
| дельта (δ) DOP | δ1, δ2 |
|
|
| каппа (κ) KOP | κ1, κ2, κ3 |
|
|
| Ноцицептиновый рецептор NOP (ORL1) | — |
|
|
Эффект анальгезии наблюдается при стимуляции μ-, δ- и κ-рецепторов. Агонисты μ-рецепторов, кроме того, вызывают угнетение дыхания и седативный эффект, а агонисты κ-рецепторов — психотомиметические эффекты. Действие большинства опиоидных анальгетиков связано со стимуляцией рецепторов μ-типа.
Механизм действия
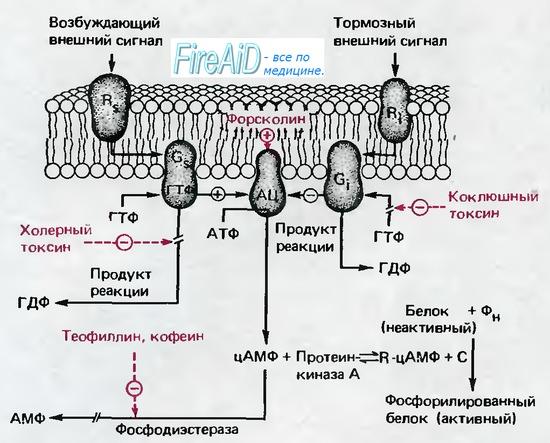
Механизм ингибирования передачи болевых импульсов в NMDA-синапсе посредством μ-опиоидных рецепторов
При активации опиоидного рецептора ингибируется аденилатциклаза, которая играет важную роль при синтезе вторичного посредника цАМФ (cAMP), а также осуществляется регулирование ионных каналов. Закрытие потенциал-зависимых кальциевых каналов в пресинаптическом нейроне приводит к уменьшению выброса возбуждающих нейромедиаторов (таких как глутаминовая кислота), а активация калиевых каналов в постсинаптическом нейроне приводит к гиперполяризации мембраны, что уменьшает чувствительность нейрона к возбуждающим нейромедиаторам.
Номенклатура[править | править код]
Опиоидные рецепторы были названы по первой букве лиганда, с которым впервые обнаружена их связь. Так, морфин был первым веществом, у которого была обнаружена способность связываться с μ-рецепторами, а κ-рецепторы названы в честь обнаружения их связывания с кетоциклазоцином. Также рецептор с высоким сродством к энкефалинам был обнаружен в семявыносящих протоках мышей и назван δ-рецептором. Позднее другой опиоидный рецептор был обнаружен и клонирован на основе гомологичности с кДНК. Этот рецептор известен как ноцицептиновый рецептор или ORL 1-рецептор.
Предположено существование отдельных подтипов опиоидных рецепторов в тканях человека, однако исследователям пока не удалось получить генетических или молекулярных доказательств их существования и считают, что они возникают в результате посттрансляционной модификации клонированных типов рецепторов или димеризации.
Подкомитет IUPHAR (англ.)русск. допускает применение общепринятой греческой классификации, но рекомендует 3 классических рецептора (μ-, δ-, κ-) и ноцицептиновый рецептор обозначать как MOP, DOP, KOP и NOP соответственно.
Примечания
- Bjorn Knollmann; Laurence Brunton; Chabner, Bruce. Goodman and Gilman’s Pharmacological Basis of Therapeutics, Twelfth Edition (SET2) (Pharmacologic Basis of Therapeutics (Goodman & Gilman)) Chapter 21. Opioid Analgesics (англ.). — McGraw-Hill Education, 2010. — ISBN 0-07-162442-2.
- ↑ Ronald D. Miller MD, Lars I. Eriksson, Lee A. Fleisher MD, Jeanine P. Wiener-Kronish MD, William L. Young. Miller’s Anesthesia. Глава «Opioids». — Churchill Livingstone, 2009. — 3312 с. — ISBN 978-0443069598.
- ↑ Norton Williams; Norman Calvey. Principles and Practice of Pharmacology for Anaesthetists. — Wiley-Blackwell, 2008. — 357 с. — ISBN 978-0632056057.
- ↑ Stein C, Schäfer M, Machelska H (2003) Attacking pain at its source: new perspectives on opioids. Nature Med;9(8):1003-1008. doi:10.1038/nm908.
- ↑ Fine, Perry G.; Russell K. Portenoy. // A Clinical Guide to Opioid Analgesia (неопр.). — McGraw-Hill Education, 2004.
- ↑
- Anil Aggrawal. . BLTC Research (1 мая 1995). Дата обращения 21 марта 2008.
- Lord JA, Waterfield AA, Hughes J, Kosterlitz HW. Nature. 1977; 267:495-499.
- Lemke, Thomas L.; Williams, David H.; Foye, William O. Opioid Analgesics; Fries, DS // Foye’s principles of medicinal chemistry (неопр.). — Hagerstown, MD: Lippincott Williams & Wilkins (англ.)русск., 2002. — ISBN 0-683-30737-1.
- Girdlestone, D. Opioid receptors; Cox BM, Chavkin C, Christie MJ, Civelli O, Evans C, Hamon MD, et al. // The IUPHAR Compendium of Receptor Characterization and Classification (англ.). — 2nd. — London: IUPHAR Media, 2000. — P. 321—333.
- Харкевич Д.А. Фармакология. — Москва: ГЭОТАР-Медиа, 2006. — 736 с. — ISBN 5-9704-0264-8.
- Bertram G. Katzung. Basic & clinical pharmacology. 11th edition. — McGraw-Hill Medical, 2009. — 1200 с. — ISBN 0071604057.
- Бунятян, Мизиков. Рациональная фармакоанестезиология. — Москва: Литтерра, 2003. — 795 с. — 7000 экз. — ISBN 5-98216-040-7.
Классификация
По действию
- Полные агонисты: морфин, героин, гидроморфон, оксиморфон, метадон, меперидин, фентанил, алфентанил, суфентанил, ремифентанил, леворфанол, оксикодон;
- Частичные агонисты: кодеин, оксикодон, гидрокодон, пропоксифен, дифеноксилат;
- Агонисты-антагонисты смешанного действия: бупренорфин, нальбуфин, буторфанол, пентазоцин, налорфин (являются агонистами или частичными агонистами к одним типам опиоидных рецепторов и антагонистами к другим);
- Антагонисты: налоксон, налтрексон, налмефен.
По происхождению
- Растительного происхождения
- Алкалоиды опийного мака: морфин, кодеин, тебаин
- Другие природные опиоиды: митрагинин, сальвинорин А
- Полусинтетические
- Синтетические
- Эндогенные (вырабатываемые самим организмом)
Фенантрены
Фенантренами или 4,5α-эпоксиморфинанами называют группу природных и полусинтетических опиоидов (опиатов), близких по структуре к морфину. Важнейшими структурными элементами морфина и других фенантреновых опиоидов являются ароматическое кольцо A и пиперидиновое кольцо D.
Размер группы замещения при атоме азота в морфиноподобных соединениях влияет на активность. Соединения с метильной группой при атоме азота, как правило, являются хорошими агонистами опиоидных рецепторов. Замена метильной группы на небольшие цепочки из 3-5 атомов углерода приводит к образованию опиоидных антагонистов, которые сохраняют сродство к опиоидным рецепторам, но не активируют их. Более крупные группы замещения при атоме азота могут возвращать соединению агонистические свойства: так, морфиноподобные соединения с фенилэтильной группой при атоме азота на порядок более активны, чем их соответствующие аналоги с метильной группой.
Гидроксильная группа при атоме C3 морфина также заметно влияет на свойства соединения. Замена её на метокси-группу приводит к образованию кодеина, очень слабого агониста μ-опиоидных рецепторов, 10 % которого метаболизируется в печени до морфина ферментом CYP2D6.
Изменения в кольце C могут приводить к получению соединений с увеличенной (по сравнению с морфином) активностью. Так, замена атома водорода в гидроксильной группе при C6 на метильную, этильную или ацетильную группы усиливает анальгезирующее действие соединения за счёт уменьшения поляризации молекулы, что делает её более липофильной и облегчает преодоление гемато-энцефалического барьера. Примером может являться 6-моноацетилморфин, активный метаболит героина. 6-кетоны гидроморфон и гидрокодон значительно более активны, чем морфин и кодеин соответственно.
Добавление гидроксильной группы при атоме C14 часто приводит к усилению действия соединения на μ-рецепторы, примерами чему являются оксикодон и оксиморфон. Модификация их структуры может приводить к образованию агонистов-антагонистов (нальбуфин) и антагонистов (налоксон, налтрексон). Реакция Дильса-Альдера с участием тебаина приводит к образованию производных 6,14-эндо-этенотетрагидротебаина, чаще называемых орипавинами. Примерами таких соединений являются эторфин и бупренорфин. Действие последнего в 20-30 раз сильнее, чем у морфина, при этом в отличие от морфина бупренорфин является частичным агонистом μ-рецепторов и антагонистом κ-рецепторов.
Морфинаны
Структура морфинанов отличается от структуры морфина удалённым эпоксидным мостиком, образующим кольцо E. Несмотря на структурное сходство с морфином и его производными, получение морфинанов осуществляется посредством полного синтеза. Примером таких соединений являются леворфанол и буторфанол, более мощные, чем соответствующие производные морфина. Правовращающие изомеры, такие как декстрометорфан, не обладают опиоидной активностью.
Как и в случае производных морфина, замена N-метильной группы может приводить к образованию опиоидных антагонистов, а гидроксилирование в позиции 14 (как у буторфанола) усиливает действие соединения.
Бензоморфаны
6,7-бензоморфаны — соединения, содержащие только кольца A, B и D. Простейшие соединения такого типа — метазоцин (с метильной группой при атоме азота) и феназоцин (с фенилэтильной группой при атоме азота) являются агонистами μ-рецепторов. Напротив, аллильная и циклопропилметильная группы при атоме азота приводят к образованию смешанных агонистов-антагонистов (обычно проявляющих агонистические свойства по отношению к κ-рецептору и антагонистические по отношению к остальным). Примером таких соединений может служить пентазоцин — слабый агонист μ-рецепторов и агонист κ-рецепторов.
Рецепторы человека[править | править код]
Рецепторы кожи
- Свободные нервные окончания — нервные окончания, состоящие только из конечных ветвлений осевого цилиндра. Располагаются в эпителии. Выступают в качестве терморецепторов, механорецепторов и ноцицепторов (то есть отвечают за восприятие изменения температуры, механических воздействий и болевые ощущения).
- Несвободные нервные окончания:
- Тельца Пачини — инкапсулированные рецепторы давления в округлой многослойной капсуле. Располагаются в подкожно-жировой клетчатке. Являются быстроадаптирующимися (реагируют только в момент начала воздействия), то есть регистрируют силу давления. Обладают большими рецептивными полями, а потому обладают грубой чувствительностью.
- Тельца Мейснера — инкапсулированные рецепторы давления, расположенные в дерме. Представляют собой слоистую структуру с нервным окончанием, проходящим между слоями. Являются быстроадаптирующимися. Обладают малыми рецептивными полями, а потому обладают тонкой чувствительностью.
- Тельца Меркеля — некапсулированные рецепторы давления. Располагаются у птиц — в дерме, у прочих позвоночных — в глубоких слоях эпидермиса. Являются медленноадаптирующимися (реагируют на всей продолжительности воздействия), то есть регистрируют продолжительность давления. Обладают малыми рецептивными полями.
- Тельца Руффини — инкапсулированные рецепторы растяжения. Являются медленноадаптирующимися, обладают большими рецептивными полями. Реагируют также на тепло.
- Колбы Краузе — инкапсулированные рецепторы, расположенные в надсосочковом слое дермы. Раньше считалось, что у Колб Краузе есть специфическая чувствительность, но их роль в качестве холодовых рецепторов не подтвердилась. .
- Рецепторы волосяных фолликулов — механорецепторы, расположенные в волосяных фолликулах и реагирующие на отклонение волоса от исходного положения.
Рецепторы мышц и сухожилий (проприоцепторы)
- Мышечные веретена — рецепторы растяжения мышц, бывают двух типов:
- с ядерной сумкой
- с ядерной цепочкой
- Сухожильный орган Гольджи — рецепторы сокращения мышц. При сокращении мышцы сухожилие растягивается и его волокна пережимают рецепторное окончание, активируя его.
Рецепторы связок
В основном представляют собой свободные нервные окончания (Типы 1, 3 и 4), меньшая группа — инкапсулированные (Тип 2). Тип 1 аналогичен окончаниям Руффини, Тип 2 — тельцам Паччини.
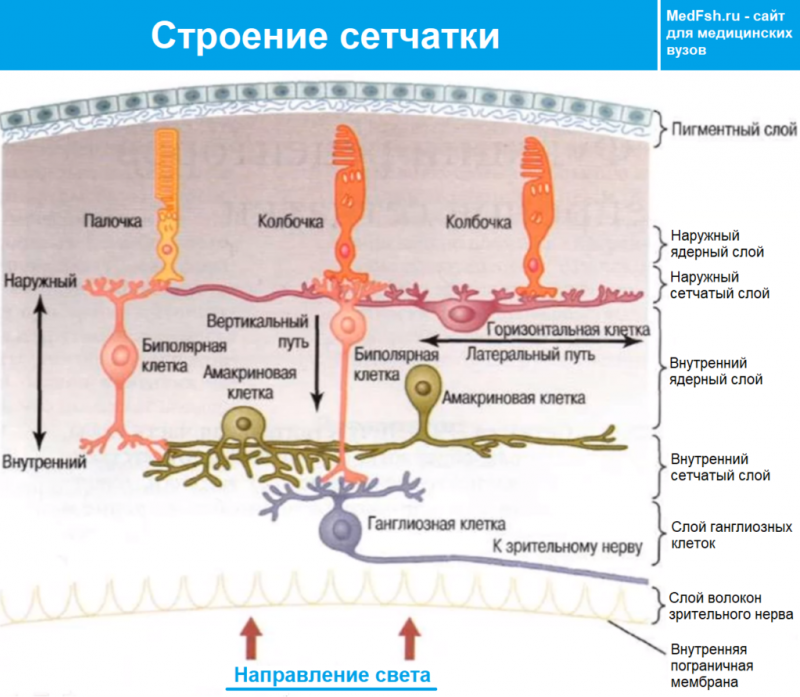
Рецепторы сетчатки глаза
Сетчатка содержит палочковые и колбочковые фоточувствительные клетки, в которых имеются светочувствительные пигменты. Палочки чувствительны к очень слабому свету, это длинные и тонкие клетки, сориентированные по оси прохождения света. Все палочки содержат один и тот же светочувствительный пигмент. Колбочки требуют намного более яркого освещения, это короткие конусообразные клетки, у человека колбочки делятся на три вида, каждый из которых содержит свой светочувствительный пигмент — это и есть основа цветового зрения.
Под воздействием света в рецепторах происходит выцветание — молекула зрительного пигмента поглощает фотон и превращается в другое соединение, хуже поглощающее свет на этой длине волны. Практически у всех животных (от насекомых до человека) этот пигмент состоит из белка, к которому присоединена небольшая молекула, близкая по структуре к витамину A. Эта молекула и представляет собой химически трансформируемую светом часть. Белковая часть выцветшей молекулы зрительного пигмента активирует молекулы трансдуцина, каждая из которых деактивирует сотни молекул циклического гуанозинмонофосфата, участвующих в открытии пор мембраны для ионов натрия, в результате чего поток ионов прекращается — мембрана гиперполяризуется.
Чувствительность палочек такова, что адаптировавшийся к полной темноте человек способен увидеть вспышку света такую слабую, что каждый рецептор получит не больше одного фотона. При этом палочки не способны реагировать на изменения освещённости, когда свет настолько ярок, что все натриевые каналы уже закрыты.
Примечания
- ↑
- Barash, Paul G. et al. Clinical Anesthesia, 5th Edition. — Lippincott Williams & Wilkins, 2006. — С. 361. — 1549 с. — ISBN 07817057452.
- (англ.) (недоступная ссылка). DEA. Дата обращения 21 декабря 2009.
- ↑
- Donald J. Abraham. Burger’s Medicinal Chemistry and Drug Discovery. Sixth Edition. Volume 6: Nervous System Agents. — Wiley, 2003. — С. 361. — 1084 с. — ISBN 0471274011.
- Barash, Paul G. et al. Clinical Anesthesia, 5th Edition. — Lippincott Williams & Wilkins, 2006. — С. 356. — 1549 с. — ISBN 07817057452.
- ↑
- Barash, Paul G. et al. Clinical Anesthesia, 5th Edition. — Lippincott Williams & Wilkins, 2006. — С. 376. — 1549 с. — ISBN 07817057452.
- Donald J. Abraham. Burger’s Medicinal Chemistry and Drug Discovery. Sixth Edition. Volume 6: Nervous System Agents. — Wiley, 2003. — С. 372—373. — 1084 с. — ISBN 0471274011.
- Donald J. Abraham. Burger’s Medicinal Chemistry and Drug Discovery. Sixth Edition. Volume 6: Nervous System Agents. — Wiley, 2003. — С. 373—376. — 1084 с. — ISBN 0471274011.
- ↑ Наркология: национальное руководство / Под ред. Н. Н. Иванца, И. П. Анохиной, М. А. Винниковой и др. — М.: «ГЭОТАР-Медиа», 2008. — С. 229—230. — 720 с. — ISBN 978-5-9704-0887-2.
- Н. Н. Иванец, Ю. Г. Тюльпин, В. В. Чирко, М. А. Кинкулькина. Психиатрия и наркология: учебник. — М.: «ГЭОТАР-Медиа», 2006. — С. 723. — 832 с. — ISBN 5-9704-0197-8.
- Berkowitz’s Pediatrics Carol D. Berkowitz (Autor) 2014 p.59
Другие рецепторы
σ-рецепторы ранее относили к опиоидным, так как считали, что противокашлевой эффект многих опиоидов реализуется через действие на эти рецепторы, а также первые селективные σ-агонисты были производными опиоидов (например, аллилнорметазоцин). Однако было обнаружено, что σ-рецепторы не активируются эндогенными опиоидными пептидами и сильно отличаются от других опиоидных рецепторов как по функции, так и по генетической структуре. Также они показали высокую чувствительность к фенциклидину и кетамину, которые являются специфическими антагонистами комплексу глутамат-N-метил-D-аспартат.:198 Кроме того, они не подвергаются реверсии налоксоном и обладают стереоселективностью к правовращающим изомерам, а опиоидные рецепторы избирательны к левовращающим изомерам.:125
Также предполагают существование других опиоидных рецепторов в связи с обнаружением эффектов эндогенных опиоидных пептидов, не опосредованных одним из четырёх известных опиоидных рецепторов. Только один из таких рецепторов был обнаружен и назван дзета (ζ-) опиоидным рецептором, который проявил себя как модулятор фактора роста клеток при действии его эндогенного лиганда — мет-энкефалина. Этот рецептор в настоящее время чаще обозначают как опиоидный рецептор фактора роста (OGFr).
Предполагают существование эпсилон (ε-) опиоидного рецептора. Такое предположение появилось после того, как у бета-эндорфина были обнаружены эффекты, которые не опосредованы каким-либо известным опиоидным рецептором. Активация ε-рецептора вызывает выраженное обезболивание и выброс мет-энкефалина и было обнаружено, что ряд широко используемых опиоидных агонистов, таких как μ-агонист эторфин и κ-агонист бремазоцин, действуют как агонисты этих эффектов (даже в присутствии антагонистов к их более известным мишеням), а бупренорфин действует как антагонист этого рецептора. В настоящее время доступны несколько селективных агонистов и антагонистов предполагаемых ε-рецепторов, однако попытки обнаружить ген этих рецепторов были безуспешны.
Другие рецепторы
σ-рецепторы ранее относили к опиоидным, так как считали, что противокашлевой эффект многих опиоидов реализуется через действие на эти рецепторы, а также первые селективные σ-агонисты были производными опиоидов (например, аллилнорметазоцин). Однако было обнаружено, что σ-рецепторы не активируются эндогенными опиоидными пептидами и сильно отличаются от других опиоидных рецепторов как по функции, так и по генетической структуре. Также они показали высокую чувствительность к фенциклидину и кетамину, которые являются специфическими антагонистами комплексу глутамат-N-метил-D-аспартат.:198 Кроме того, они не подвергаются реверсии налоксоном и обладают стереоселективностью к правовращающим изомерам, а опиоидные рецепторы избирательны к левовращающим изомерам.:125
Также предполагают существование других опиоидных рецепторов в связи с обнаружением эффектов эндогенных опиоидных пептидов, не опосредованных одним из четырёх известных опиоидных рецепторов. Только один из таких рецепторов был обнаружен и назван дзета (ζ-) опиоидным рецептором, который проявил себя как модулятор фактора роста клеток при действии его эндогенного лиганда — мет-энкефалина. Этот рецептор в настоящее время чаще обозначают как опиоидный рецептор фактора роста (OGFr).
Предполагают существование эпсилон (ε-) опиоидного рецептора. Такое предположение появилось после того, как у бета-эндорфина были обнаружены эффекты, которые не опосредованы каким-либо известным опиоидным рецептором. Активация ε-рецептора вызывает выраженное обезболивание и выброс мет-энкефалина и было обнаружено, что ряд широко используемых опиоидных агонистов, таких как μ-агонист эторфин и κ-агонист бремазоцин, действуют как агонисты этих эффектов (даже в присутствии антагонистов к их более известным мишеням), а бупренорфин действует как антагонист этого рецептора. В настоящее время доступны несколько селективных агонистов и антагонистов предполагаемых ε-рецепторов, однако попытки обнаружить ген этих рецепторов были безуспешны.