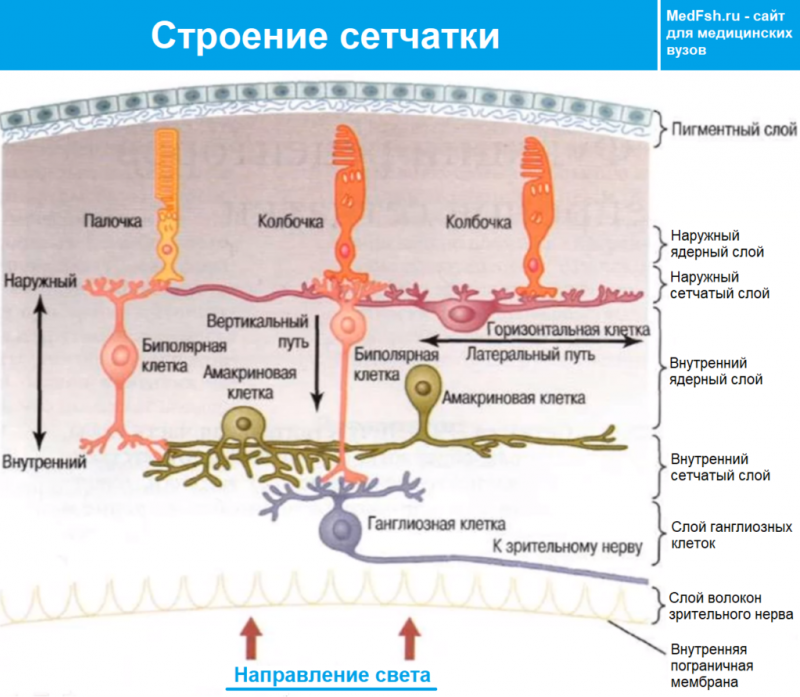
Холинергические синапсы: строение, функции
Содержание:
Вещества, которые воздействуют на холинергические синапсы
Фармакологические и разнообразные химические вещества способны воздействовать на множество процессов, которые связаны с синаптической передачей:
- Процесс синтеза ацетилхолина.
- Процесс высвобождения медиатора. К примеру, карбахолин способен усиливать процесс выделения ацетилхолина, а может препятствовать процессу высвобождения медиатора.
- Процесс взаимодействия между ацетилхолином и холинорецептором.
- Гидролиз ацетилхолина энзиматической природы.
- Процесс захвата холина, образованного в результате гидролиза ацетилхолина, пресинаптическими окончаниями. К примеру, гемихолиний способен угнетать нейроновый захват и транспортировку холина в цитоплазму клетки.
Свойства
Применяется в качестве лекарственного вещества и для фармакологических исследований. Это соединение получают синтетическим путём в виде хлорида или другой соли.
Химические
Ацетилхолин является ацетильным производным четвертичного аммониевого соединения — холина. Образуется в нервных клетках человека и животных из холина в результате ферментативной реакции, под действием холин-ацетилтрансферазы происходит перенос ацетильной группы (СН3СО-) от ацетил-КоА на молекулу субстрата холина, с образованием кофермента А и АЦХ по уравнению реакции:
- ацетил-КоА + холин ⇌{\displaystyle \rightleftharpoons } ацетилхолин + КoA-SH.
Наличие данного фермента в нервных клетках классифицирует такую клетку, как «холинергический» нейрон.
Это химически нестойкое вещество, которое в организме при участии специфического фермента холинэстеразы (ацетилхолинэстеразы) легко разрушается с образованием холина и уксусной кислоты.
Физические
Бесцветные кристаллы или белая кристаллическая масса. Расплывается на воздухе. Легко растворим в воде и спирте. При кипячении и длительном хранении растворы разлагаются.
Медицинские
Физиологическое холиномиметическое действие ацетилхолина обусловлено стимуляцией им терминальных мембран м- и н-холинорецепторов.
Периферическое мускариноподобное действие ацетилхолина проявляется в замедлении сердечных сокращений, расширении периферических кровеносных сосудов и понижении артериального давления, усилении перистальтики желудка и кишечника, сокращении мускулатуры бронхов, матки, жёлчного и мочевого пузыря, усилении секреции пищеварительных, бронхиальных, потовых и слёзных желез, миоз. Миотический эффект связан с усилением сокращения круговой мышцы радужной оболочки, которая иннервируется постганглионарными холинергическими волокнами глазодвигательного нерва. Одновременно в результате сокращения ресничной мышцы и расслабления цинновой связки ресничного пояска наступает спазм аккомодации.
Сужение зрачка, обусловленное действием ацетилхолина, сопровождается обычно понижением внутриглазного давления. Этот эффект частично объясняется тем, что при сужении зрачка и уплощении радужной оболочки расширяется шлеммов канал (венозный синус склеры) и фонтановы пространства (пространства радужно-роговичного угла), что обеспечивает лучший отток жидкости из внутренних сред глаза. Не исключено, что в понижении внутриглазного давления принимают участие и другие механизмы. В связи со способностью снижать внутриглазное давление вещества, действующие подобно ацетилхолину (холиномиметики, антихолинэстеразные препараты), имеют широкое применение для лечения глаукомы. Следует учитывать, что при введении этих препаратов в конъюнктивальный мешок они всасываются в кровь и, оказывая резорбтивное действие, могут вызвать характерные для этих препаратов побочные явления. Следует также иметь в виду, что длительное (в течение ряда лет) применение миотических веществ может иногда привести к развитию стойкого (необратимого) миоза, образованию задних синехий и другим осложнениям, а длительное применение в качестве миотиков антихолинэстеразных препаратов может способствовать развитию катаракты.
Ацетилхолину принадлежит также важная роль как медиатору ЦНС. Он участвует в передаче импульсов в разных отделах мозга, при этом малые концентрации облегчают, а большие — тормозят синаптическую передачу. Изменения в обмене ацетилхолина приводят к грубому нарушению функций мозга. Недостаток его во многом определяет клиническую картину такого опасного нейродегенеративного заболевания, как болезнь Альцгеймера. Некоторые центральнодействующие антагонисты ацетилхолина (см. Амизил) являются психотропными препаратами (см. также Атропин). Передозировка антагонистов ацетилхолина может вызвать нарушения высшей нервной деятельности (оказывать галлюциногенный эффект и др.). Антихолинэстеразное действие ряда ядов основано именно на способности вызывать накопление ацетилхолина в синаптических щелях, перевозбуждение холинэргических систем и более или менее быструю смерть (хлорофос, карбофос, зарин, зоман).
Участие в процессах жизнедеятельности
Образующийся в организме (эндогенный) ацетилхолин играет важную роль в процессах жизнедеятельности: он принимает участие в передаче нервного возбуждения в ЦНС, вегетативных узлах, окончаниях парасимпатических и двигательных нервов. Ацетилхолин связан с функциями памяти. Снижение ацетилхолина при болезни Альцгеймера приводит к ослаблению памяти у пациентов. Ацетилхолин играет важную роль в засыпании и пробуждении. Пробуждение происходит при увеличении активности холинергических нейронов в базальных ядрах переднего мозга и стволе головного мозга.
Ацетилхолин вырабатывают нейроны базальных ядер, которые активируются во время концентрации внимания.
Физиологические свойства
Ацетилхолин является химическим передатчиком (медиатором) нервного возбуждения; окончания нервных волокон, для которых он служит медиатором, называются холинергическими, а рецепторы, взаимодействующие с ним, называют холинорецепторами. Холинорецептор (по современной зарубежной терминологии — «холиноцептор») является сложной белковой макромолекулой (нуклеопротеидом), локализованной на внешней стороне постсинаптической мембраны. При этом холинорецептор постганглионарных холинергических нервов (сердца, гладких мышц, желез) обозначают как м-холинорецепторы (мускариночувствительные), а расположенные в области ганглионарных синапсов и в соматических нервномышечных синапсах — как н-холинорецепторы (никотиночувствительные). Такое деление связано с особенностями реакций, возникающих при взаимодействии ацетилхолина с этими биохимическими системами: мускариноподобных в первом случае и никотиноподобных — во втором; м- и н-холинорецепторы находятся также в разных отделах ЦНС.
По современным данным, мускариночувствительные рецепторы делят на М1-, М2- и М3-рецепторы, которые по-разному распределяются в органах и разнородны по физиологическому значению (см. Атропин, Пиренцепин).
Ацетилхолин не оказывает строгого избирательного действия на разновидности холинорецепторов. В той или другой степени он действует на м- и н-холинорецепторы и на подгруппы м-холинорецепторов. Периферическое никотиноподобное действие ацетилхолина связано с его участием в передаче нервных импульсов с преганглионарных волокон на постганглионарные в вегетативных узлах, а также с двигательных нервов на поперечнополосатую мускулатуру. В малых дозах он является физиологическим передатчиком нервного возбуждения, в больших дозах может вызвать стойкую деполяризацию в области синапсов и блокировать передачу возбуждения.
Общая характеристика
Данный рецептор найден в химических синапсах как в центральной, так и в периферической нервной системе, в нервно-мышечных синапсах, а также в эпителиальных клетках многих видов животных.
Никотиновый ацетилхолиновый рецептор был открыт в начале XX века, как «рецепторная структура никотина», приблизительно за 25-30 лет до того, как была исследованная его роль в проведении нервных сигналов, генерируемых с помощью ацетилхолина. При попадании ацетилхолина на молекулу данного рецептора приоткрывается проницаемый для катионов канал, что приводит к деполяризации клеточной мембраны и генерации нервного импульса в нейроне или сокращению мышечного волокна (в случае нервно-мышечного синапса).
Функции
Мускариновые рецепторы несут целый набор разнообразных физиологических функций. В частности, они представлены в автономных ганглиях и постганглиозных волокнах, которые отходят от этих ганглиев к органам-мишеням. Таким образом, эти рецепторы принимают участие в передаче и модуляции таких парасимпатичних эффектов, как сокращение гладкой мускулатуры, расширение сосудов, снижение частоты сердечных сокращений, и повышение секреции в железах.
В ЦНС холинергические волокна, в состав которых входят интернейроны с мускариновыми синапсами, локализованы в коре головного мозга, ядрах ствола мозга, гиппокампе, стриатуме и в меньшем количестве — во многих других регионах. Центральные мускариновые рецепторы оказывают влияние на регуляцию сна, внимания, обучение и памяти. Менее важными функциональными характеристиками данных рецепторов является участие в регуляции движений конечностей, анальгезии и регуляции температуры тела.
Рецепторы типа М2 и М4 могут встречаться на пресинаптических мембранах и регулируют высвобождение медиатора в синапсе; но в основном мускариновые рецепторы типов М2 и М4 являются постсинаптическими.
Рецепторы типа М1 принимают участие в регуляции проведения калиевых каналов, и в подавлении медленных, вольт-независимых кальциевых токов. Рецепторы типа М2 принимают участие в формировании брадикардии, сокращении гладкой мускулатуры желудка, мочевого пузыря и трахее. Рецепторы типа М3 влияют на секрецию слюны, сужение зрачков и сокращение желчного пузыря. Рецепторы типа М4 привлечены в процессы регулирования некоторых аспектов локомоторной активности (включая модуляцию эффектов дофамина).
Функции
Мускариновые рецепторы несут целый набор разнообразных физиологических функций. В частности, они представлены в автономных ганглиях и постганглиозных волокнах, которые отходят от этих ганглиев к органам-мишеням. Таким образом, эти рецепторы принимают участие в передаче и модуляции таких парасимпатичних эффектов, как сокращение гладкой мускулатуры, расширение сосудов, снижение частоты сердечных сокращений, и повышение секреции в железах.
В ЦНС холинергические волокна, в состав которых входят интернейроны с мускариновыми синапсами, локализованы в коре головного мозга, ядрах ствола мозга, гиппокампе, стриатуме и в меньшем количестве — во многих других регионах. Центральные мускариновые рецепторы оказывают влияние на регуляцию сна, внимания, обучение и памяти. Менее важными функциональными характеристиками данных рецепторов является участие в регуляции движений конечностей, анальгезии и регуляции температуры тела.
Рецепторы типа М2 и М4 могут встречаться на пресинаптических мембранах и регулируют высвобождение медиатора в синапсе; но в основном мускариновые рецепторы типов М2 и М4 являются постсинаптическими.
Рецепторы типа М1 принимают участие в регуляции проведения калиевых каналов, и в подавлении медленных, вольт-независимых кальциевых токов. Рецепторы типа М2 принимают участие в формировании брадикардии, сокращении гладкой мускулатуры желудка, мочевого пузыря и трахеи. Рецепторы типа М3 влияют на секрецию слюны, сужение зрачков и сокращение желчного пузыря. Рецепторы типа М4 привлечены в процессы регулирования некоторых аспектов локомоторной активности (включая модуляцию эффектов дофамина).
Классификация
М-холинорецепторы расположены в постсинаптической мембране клеток эффекторных органов у окончаний постганглионарных холинергических (парасимпатических) волокон. Кроме того, они имеются на нейронах вегетативных ганглиев и в ЦНС — в коре головного мозга, ретикулярной формации). Установлена гетерогенность м-холинорецепторов разной локализации, что проявляется в их неодинаковой чувствительности к фармакологическим веществам.
Выделяют следующие виды м-холинорецепторов:
- м1-холинорецепторы в ЦНС и в вегетативных ганглиях (однако последние локализуются вне синапсов);
- м2-холинорецепторы — основной подтип м-холинорецепторов в сердце; некоторые пресинаптические м2-холинорецепторы снижают высвобождение ацетилхолина;
- м3-холинорепепторы — в гладких мышцах, в большинстве экзокринных желез;
- м4-холинорецепторы — в сердце, стенке легочных альвеол, ЦНС;
- м5-холинорецепторы — в ЦНС, в слюнных железах, радужной оболочке, в мононуклеарных клетках крови.
Мускариновые рецепторы были первоначально разделены фармакологически на М1 и М2 типы, на основании различия в их чувствительности к пирензепину, оказавшемуся селективном антагонистом М1 рецептора. Было доказано, что стимуляция М1 рецептора активирует фосфолипазу С (PLC), приводя к высвобождению вторичного мессенджера инозитол 3-фосфата и последующей мобилизации внутриклеточного кальция. Активация M2 рецептора подавляет активность аденилатциклазы, что приводит к уменьшению внутриклеточного уровня сАМР.
Мускариновые рецепторы можно разделить на подтипы в соответствии с их способностью мобилизовать внутриклеточный кальций (m1,m3,m5) или ингибировать аденилатциклазу (m2,m). Подтипы m1, m3 и m5 активируют фосфолипазы А2, С и D, тирозинкиназу и вход кальция. Подтипы M2, M также увеличивают активность фосфолипазы А2. В передаче сигнала с b-адренергического рецептора G белки.
Структура
Мускариновый рецептор любого типа состоит из одной полипептидной цепи длиной 440—540 остатков аминокислот, с внеклеточным N-концом и внутриклеточным С-концом. Гидропатический анализ аминокислотной последовательности выявил семь отрезков длиной в 20-24 остатков, которые формируют спиралевидные структуры, пронизывающие клеточную мембрану нейрона. Аминокислотная последовательность в этих отрезках является очень консервативной (более чем 90 % совпадений) во всех пяти типах мускариновых рецепторов. Между пятым и шестым доменами, которые пронизывают мембрану, находится большая внутриклеточная петля, которая является очень вариативной по своему составу и размерам у разных типов рецепторов. На третьей внутриклеточной петле, а также на С-конце рецепторной молекулы, расположено несколько последовательных отрезков, на которых происходит фосфорилирование при передаче нервного импульса. Остатки цистеина, один из которых расположен близ третьего трансмембранного сегмента, а другой — в середине второй внеклеточной петли, связаны дисульфидным мостиком.
Благодаря мутационному анализу были выявлены участки на рецепторной молекуле, которые вовлечены в процесс связывания лиганда и G-белков. Ацетилхолин связывается с участком, который находится в складке, сформированной спирально закрученными трансмембранными доменами. Остаток аспартата в третьем трансмембранном домене принимает участие в ионном взаимодействии с четвертичным азотом ацетилхолина, в то время как последовательности остатков тирозина и треонина, расположенные в трансмембранных сегментах приблизительно на трети расстояния от поверхности мембраны, формируют водородные связи с мускарином и его производными. Согласно результатам фармакологических исследований, сайт связывания антагонистов перекрывает сайт, с которым связывается ацетилхолин, но в дополнение привлекает к своему составу гидрофобные участки белковой молекулы рецептору и окружающей клеточной мембраны. Мускариновые рецепторы, кроме того, содержат сайт (или сайты), благодаря которым происходит регуляция рецепторного ответа большим количеством соединений, в частности галамином, который снижает степень диссоциации холинергических лигандов. Сайт связывания галамина включает шестой трансмембранный домен, а также третью внешнеклеточную петлю.
Большое количество участков данного рецептора принимают участие во взаимодействии с передающими G-белками. Это особенно касается структур второй внутриклеточной петли и N- и С-терминальных отрезков третьей внутриклеточной петли. Десенситизация мускаринових рецепторов, достоверно, вызывает фосфориляцию треониновых остатков на С-терминальном отрезке рецепторной молекулы, а также на нескольких участках третьей внутриклеточной петли.
Биохимия
Ацетилхолин синтезируется в цитоплазме окончаний холинергических нейронов . Образуется он из холина и ацетилкоэнзима А (митохондриального происхождения) при участии цитоплазматического фермента холинацетилазы (холин-ацетилтрансферазы). Депонируется ацетилхолин в синаптических пузырьках (везикулах). В каждом из них находится несколько тысяч молекул ацетилхолина. Нервные импульсы вызывают высвобождение ацетилхолина в синаптическую щель, после чего он взаимодействует с холинорецепторами.
По имеющимся данным, холинорецептор нервно-мышечных синапсов включает 5 белковых субъединиц (α, α, β, γ, δ), окружающих ионный (натриевый) канал и проходящих через всю толщу липидной мембраны. Две молекулы ацетилхолина взаимодействуют с двумя α-субъединицами, что приводит к открыванию ионного канала и деполяризации постсинаптической мембраны.
Биохимия
Ацетилхолин синтезируется в цитоплазме окончаний холинергических нейронов . Образуется он из холина и ацетилкоэнзима А (митохондриального происхождения) при участии цитоплазматического фермента холинацетилазы (холин-ацетилтрансферазы). Депонируется ацетилхолин в синаптических пузырьках (везикулах). В каждом из них находится несколько тысяч молекул ацетилхолина. Нервные импульсы вызывают высвобождение ацетилхолина в синаптическую щель, после чего он взаимодействует с холинорецепторами.
По имеющимся данным, холинорецептор нервно-мышечных синапсов включает 5 белковых субъединиц (α, α, β, γ, δ), окружающих ионный (натриевый) канал и проходящих через всю толщу липидной мембраны. Две молекулы ацетилхолина взаимодействуют с двумя α-субъединицами, что приводит к открыванию ионного канала и деполяризации постсинаптической мембраны.
Разновидности никотиновых рецепторов
| Разновидности никотиновых рецепторов и их фармакологические свойства | ||||
|---|---|---|---|---|
| Анатомическая локализация | Субъединичный состав | ACh-чувствительность (ЕС50) и кинетическая характеристики | Агонисты | Антагонисты |
| Электрические органы рыб | α12β1γδ | 0.3μM | Карбамоилхолин | (+)-тубокукарин |
| Мышечная система рыб | α12β1εδ | — | Анатоксин | α-бунгаротоксин |
| ЦНС | α7 | 120μM, быстрая десенситизация | Производные анабазина | α-бунгаротоксин, метилликаконитин |
| Автономные ганглии ЦНС | α4β2 | 0.3μM, медленная десенсетизация | Эпибатидин, никотин, n-этилкарбамоилхолин | дигидро-β-эритроидин, κ-бунгаротоксин |
| ЦНС | α3β4 | 0.1μM, медленная десенсетизация | Ацетилхолин | Мекамиламин |
| Кератиноциты | α3β2 | 0.1μM | Ацетилхолин, анатоксин, никотин | Мекамиламин, κ-бунгаротоксин |
Электрические синапсы
Кроме синапсов с химической передачей возбуждения в организме есть синапсы с электрической передачей. Эти синапсы имеют очень узкую синаптическую щель и пониженное электрическое сопротивление между двумя мембранами. Благодаря наличию поперечных каналов между мембранами и низкому сопротивлению, электрический импульс легко проходит через мембраны. Электрические синапсы обычно характерны для однотипных клеток.
В результате воздействия раздражителя пресинаптический потенциал действия раздражает постсинаптическую мембрану, где возникает распространяющийся потенциал действия.
Характеризуются большей скоростью проведения возбуждения по сравнению с химическими синапсами и низкой чувствительностью к воздействию химических веществ.
Электрические синапсы бывают с одно- и двусторонней передачей возбуждения.
В организме встречаются и электрические тормозные синапсы. Тормозное влияние развивается за счет действия тока, который вызывает гиперполяризацию постсинаптической мембраны.
В смешанных синапсах может происходить передача возбуждения с помощью как электрических импульсов, так и медиаторов.
6. М-холиномиметические средства.
7. Н-холиномиметические средства. Применение никотиномиметиков для борьбы с табакокурением.
8. М-холиноблокирующие средства.
9. Ганглиоблокирующие средства.
11. Адреномиметические средства.
14. Средства для общей анестезии. Определение. Детерминанты глубины, скорости развития и выхода из наркоза. Требования к идеальному наркотическому средству.
15. Средства для ингаляционного наркоза.
16. Средства для неингаляционного наркоза.
17. Спирт этиловый. Острое и хроническое отравление. Лечение.
18. Седативно-гипнотические средства. Острое отравление и меры помощи.
19. Общие представления о проблеме боли и обезболивании. Средства, используемые при нейропатических болевых синдромах.
20. Наркотические анальгетики. Острое и хроническое отравление. Принципы и средства лечения.
21. Ненаркотические анальгетики и антипиретики.
22. Противоэпилептические средства.
23. Средства, эффективные при эпилептическом статусе и других судорожных синдромах.
24. Противопаркинсонические средства и средства для лечения спастичности.
32. Средства для предупреждения и купирования бронхоспазма.
33. Отхаркивающие и муколитические средства.
34. Противокашлевые средства.
35. Средства, применяемые при отеке легких.
36. Средства, применяемые при сердечной недостаточности (общая характеристика) Негликозидные кардиотонические средства.
37. Сердечные гликозиды. Интоксикация сердечными гликозидами. Меры помощи.
38. Противоаритмические средства.
39. Антиангинальные средства.
40. Основные принципы лекарственной терапии инфаркта миокарда.
41. Антигипертензивные симпатоплегические и вазорелаксирующие средства.
I. Средства, влияющие на аппетит
II. Средства при снижении секреции желудка
I. Производные сульфонилмочевины
70. Противомикробные средства. Общая характеристика. Основные термины и понятия в области химиотерапии инфекций.
71. Антисептики и дезинфицирующие средства. Общая характеристика. Отличие их от химиотерапевтических средств.
72. Антисептики – соединения металлов, галогенсодержащие вещества. Окислители. Красители.
73. Антисептики алифатического, ароматического и нитрофуранового ряда. Детергенты. Кислоты и щелочи. Полигуанидины.
74. Основные принципы химиотерапии. Принципы классификации антибиотиков.
75. Пенициллины.
76. Цефалоспорины.
77. Карбапенемы и монобактамы
78. Макролиды и азалиды.
79. Тетрациклины и амфениколы.
80. Аминогликозиды.
81. Антибиотики группы линкозамидов. Фузидиевая кислота. Оксазолидиноны.
82. Антибиотики гликопептиды и полипептиды.
83. Побочное действие антибиотиков.
84. Комбинированная антибиотикотерапия. Рациональные комбинации.
85. Сульфаниламидные препараты.
86. Производные нитрофурана, оксихинолина, хинолона, фторхинолона, нитроимидазола.
87. Противотуберкулезные средства.
88. Противоспирохетозные и противовирусные средства.
89. Противомалярийные и противоамебные средства.
90. Средства, применяемые при жиардиазе, трихомониазе, токсоплазмозе, лейшманиозе, пневмоцистозе.
91. Противомикозные средства.
I. Средства, применяемые при лечении заболеваний, вызванных патогенными грибами
II. Средства, применяемые при лечении заболеваний, вызванных условно-патогенными грибами (например, при кандидамикозе)
92. Антигельминтные средства.
93. Противобластомные средства.
94. Средства, применяемые при чесотке и педикулёзе.
Электрические синапсы
Кроме синапсов с химической передачей возбуждения в организме есть синапсы с электрической передачей. Эти синапсы имеют очень узкую синаптическую щель и пониженное электрическое сопротивление между двумя мембранами. Благодаря наличию поперечных каналов между мембранами и низкому сопротивлению, электрический импульс легко проходит через мембраны. Электрические синапсы обычно характерны для однотипных клеток.
В результате воздействия раздражителя пресинаптический потенциал действия раздражает постсинаптическую мембрану, где возникает распространяющийся потенциал действия.
Характеризуются большей скоростью проведения возбуждения по сравнению с химическими синапсами и низкой чувствительностью к воздействию химических веществ.
Электрические синапсы бывают с одно- и двусторонней передачей возбуждения.
В организме встречаются и электрические тормозные синапсы. Тормозное влияние развивается за счет действия тока, который вызывает гиперполяризацию постсинаптической мембраны.
В смешанных синапсах может происходить передача возбуждения с помощью как электрических импульсов, так и медиаторов.
Токсикология
Токсины, способные подавлять функционирование никотиновых рецепторов, найдены во многих представителях растительного и животного царств. Специфическим блокатором никотиновых ацетилхолиновых рецепторов является α-анатоксин, синтезируемый синезелёными водорослями вида Anabaena flosaquae. Эти водоросли, активно размножающиеся в пресных водоемах в периоды их «цветения», высокотоксичны для многих гидробионтов (включая рыб) и могут приводить к их массовой гибели. Некоторые растительные яды, содержащие вещества, способные поражать никотиновые рецепторы (тубокурарин, физостигмин, метилликаконитин и др.), издревле используются дикими племенами для войн и охоты. Из представителей животного царства ядами подобного действия обладают некоторые змеи (α-бунгаротоксин) и лягушки (гистрионикотоксин). Среди неорганических веществ специфическими блокаторами этого вида рецепторов являются соли свинца, чем в значительной степени и объясняются их нейротоксические эффекты.
В открытом состоянии никотиновые рецепторы мышечного типа блокируются большим количеством специфических лигандов — блокираторов ионного канала. К ним относятся местные анестетики (бупивакаин, пиперокаин, лидокаин), антимускариновые соединения (атропин, скополамин), антагонисты с наркотическим эффектом (налтрексон), специфические токсины (гистрионикотоксин), антивирусные вещества и антибиотики (амантадин, квинакрин), стимуляторы (никотин), психотропные вещества (кокаин), и фосфорорганические соединения (ДФФ, ТЭПФ, зарин, VX). Несмотря на разную химическую природу, эти агенты-блокираторы представляют собой в большинстве случаев молекулы, положительно заряженные на большей части поверхности. Учитывая то, что место, связывание с которым обеспечивает блокирование ионного канала, является чувствительным к заряду клеточной мембраны, действие блокираторов этого канала является также электрозависимым; при гиперполяризационных значениях заряда мембраны блокирования происходит наиболее активно.
Структура
Схема н-холинорецептора с ионным каналом
Образование пентамера из субъединиц
Высокая концентрация никотиновых ацетилхолиновых рецепторов в электрических органах некоторых скатов, в частности у калифорнийского гнюса и мраморного электрического ската, вместе с выделением α-бунгаротоксина (αBGT — полипептида из яда южнокитайского многополосого крайта, который является необратимым лигандом и специфическим антагонистом ацетилхолина для никотиновых рецепторов в нервно-мышечных синапсах), позволила биохимически очистить и детально исследовать никотиновые ацетилхолиновые рецепторы, а также идентифицировать место связывания ацетилхолина. Было доказано, что данный рецептор является гетероолигомерным комплексом, состоящим из четырех разных белковых субъединиц, которые были названы соответственно их молекулярной массе (в килодальтонах): α (40), β (50), γ (60), δ (65). При естественной экспрессии в клетке сначала возникают димерные комплексы α-γ и α-δ, потом формируется тример α-β-δ, и наконец, после объединения димера и тримера, в клеточную мембрану встраивается функциональный пентамер со стехиометрией α2βγδ.
Основное место связывания агониста ацетилхолина расположено на внешне-клеточной поверхности каждой из α-субъединиц, рядом с сегментом М1, и окружено двумя соседними остатками цистеина (номера 192 и 193 в первичной структуре); для формирования функционального места связывания, данные цистеиновые остатки должны быть объединены дисульфидным мостиком между входящими в их состав атомами серы. Также для связывания ацетилхолина важным (но не всегда критическим) фактором является наличие в данном месте остатков тирозина и триптофана. Место связывания ацетилхолина сформировано тремя параллельными α-спиралями белковой молекулы, благодаря чему оно находится в углублении между ними. Для открытия ионного канала рецептора внешнеклеточный домен на α-субъединице, расположенный в районе остатка Lys-125 на расстоянии около 10 Ангстрем от места связывания ацетилхолина, распознается не ацетилхолином, а эндогенным соединением 5-гидрокситриптамином, а также особым классом агонистов — производных физостигмина. Регион близ остатка Lys-125 и соседние части рецепторной макромолекулы, которые включают дисульфидный мостик (Cys128-Cys142), являются очень похожими во всех субъединицах никотиновых рецепторов. Учитывая то, что β-, γ- и δ-субъединицы лишены агонист-связывающего места, они называются «структурными» субъединицами.
Трансмембранная часть рецептора образует ионный канал, стенки которого сформированы сегментами М2 всех пяти субъединиц. Было доказано, что относительно небольшие пертурбации, а именно поворот на 4° двух агонист-связывающих субъединиц, приводят к значительному смещению сегментов М2 и открытию поры ионного канала, что является условием возникновения катионного тока через рецептор.
Электрические синапсы
Кроме синапсов с химической передачей возбуждения в организме есть синапсы с электрической передачей. Эти синапсы имеют очень узкую синаптическую щель и пониженное электрическое сопротивление между двумя мембранами. Благодаря наличию поперечных каналов между мембранами и низкому сопротивлению, электрический импульс легко проходит через мембраны. Электрические синапсы обычно характерны для однотипных клеток.
В результате воздействия раздражителя пресинаптический потенциал действия раздражает постсинаптическую мембрану, где возникает распространяющийся потенциал действия.
Характеризуются большей скоростью проведения возбуждения по сравнению с химическими синапсами и низкой чувствительностью к воздействию химических веществ.
Электрические синапсы бывают с одно- и двусторонней передачей возбуждения.
В организме встречаются и электрические тормозные синапсы. Тормозное влияние развивается за счет действия тока, который вызывает гиперполяризацию постсинаптической мембраны.
В смешанных синапсах может происходить передача возбуждения с помощью как электрических импульсов, так и медиаторов.
Частная фармакология
1. Схема функциональной организации периферической нервной системы. Передача возбуждения в холинергических и адренергических синапсах.
Эффекты, вызванные повышением активности симпатического отдела
Радужка – сокращение радиальной мышцы (a 1 -Ар)
Цилиарная мышца – расслабляется (b-Ар)
2) сердце:
Синоатриальный узел, эктопические пейсмейкер – ускорение (b 1 -Ар)
Сократимость – повышается (b 1 -Ар)
3) ГМК сосудов:
Кожа, сосуды внутренних органов – сокращаются (a-Ар)
Сосуды скелетных мышц – расслабляются (b 2 -Ар)
4) бронхиолярные ГМК: расслабляются (b 2 -Ар)
ГМК стенок – расслабляются (a 2 , b 2 -Ар)
ГМК сфинктеров – сокращаются (a 1 -Ар)
Мышечное сплетение – угнетается (a-Ар)
Стенки мочевого пузыря – расслабляются (b 2 -Ар)
Сфинктер – сокращается (a 1 -Ар)
Матка при беременности – расслабляется (b 2 -Ар) или сокращается (a-Ар)
Пенис, семенные пузырьки – эякуляция (a-Ар)
Пиломоторные ГМК — сокращаются (a-Ар)
Потовые железы: терморегуляторные – активация (М-Хр), апокриновые – активация (a-Ар)
8) метаболические функции:
Печень: глюконеогенез и глюкогенолез (a/b 2 -Ар)
Жировые клетки: липолиз (b 3 -Ар)
Почки: выделение ренина (b 1 -Ар)
Эффекты, обусловленные повышением тонуса парасимпатического отдела
Автономной нервной системы.
Радужка – сокращение циркулярной мышцы (М 3 -Хр)
Цилиарная мышца – сокращается (М 3 -Хр)
2) сердце:
Синоатриальный узел – замедляется (М 2 -Хр)
Сократимость – замедляется (М 2 -Хр)
3) ГМК сосудов:
Эндотелий – выделение эндотелиального релаксирующего фактора NO (М 3 -Хр)
4) бронхиолярные ГМК: сокращаются (М 3 -Хр)
ГМК стенок – сокращаются (М 3 -Хр)
ГМК сфинктеров – расслабляются (М 3 -Хр)
Секреция – повышается (М 3 -Хр)
Мышечное сплетение – активируется (М 1 -Хр)
Стенки мочевого пузыря – сокращаются (М 3 -Хр)