Протеолиз
Содержание:
- Типы протеаз
- Абсорбция ПФ в желудочно-кишечном тракте и их биологическая активность
- Ограниченный протеолиз
- Протеолитическое средство для местного применения — 20 лекарственных препаратов
- ТОП-6 польза протеазы
- 1.Действие протеазы в организме для улучшения пищеварения
- 2.Действие протеазы в организме — способствование поглощению аминокислот
- 3.Действие протеазы в организме — повышает иммунную функцию
- 4.Действие протеазы в организме — предотвращает образование тромбов и атеросклероз
- 5.Действие протеазы в организме — ускоряет восстановление тканей
- 6.Действие протеазы в организме — помогает предотвратить рак толстой кишки
- I. Растительные протеазы.
- Функции панкреатических ферментов в организме – исторические факты
- Функция и механизм
- Что такое панкреатические ферменты? В чем заключаются функции панкреатических ферментов в организме?
- Что такое протеаза? Определение протеазы и роль в организме
- Специфичность
- Ферменты поджелудочной железы. Источники и дозировки
Типы протеаз
Ферменты протеазы часто классифицируются на основании их происхождения. Некоторые протеазы вырабатываются в нашем организме, некоторые в растениях, а другие имеют микробное происхождение. Различные типы протеаз имеют разные биологические процессы и механизмы.
Наша пищеварительная система естественным образом производит три типа протеаз: пепсин, трипсин и химотрипсин. Вот разбивка этих трех типов протеаз:
Пепсин
Пепсин — это природная протеаза, которая содержится в кишечнике. Он необходим для расщепления и переваривания белков. Клетки желудка начинают вырабатывать неактивный фермент, называемый пепсиноген, превращающийся в пепсин, когда он попадает в кислую среду желудка. Затем пепсин разрушает химические связи в белках, производя более мелкие молекулы, называющиеся пептидами. Это первая фаза переваривания белка.
трипсин
Трипсин — это протеазный фермент, который вырабатывается в поджелудочной железе в неактивной форме, называемой трипсиногеном. Затем он смешивается с желчью и попадает в тонкий кишечник, где превращается в активный трипсин. Трипсин работает с пепсином и химотрипсином для расщепления белков на пептиды и аминокислоты.
Chymotrypsin
Химотрипсин также вырабатывается в поджелудочной железе и действует как компонент сока поджелудочной железы в тонкой кишке. Он расщепляет молекулы белка на пептиды. Химотрипсин активируется в присутствии трипсина.
Протеазы также содержатся в определенных пищевых продуктах и доступны в виде добавок. Существуют два типа ферментов протеаз на растительной основе:
Бромелайн
Бромелайн — протеаза, которая содержится в стебле и соке ананаса. Добавки бромелайна обычно используются при расстройствах пищеварения, более быстром восстановлении после операций или травм. А также симптомов аллергии, синусовых инфекций и болей в суставах.
Папаин
Папаин — это протеазный фермент, который содержится в латексе папайи, особенно когда он незрелый. Папаин стимулирует пищеварение и улучшает общее усвоение питательных веществ, поэтому его часто используют в пищеварительных ферментных добавках.
Абсорбция ПФ в желудочно-кишечном тракте и их биологическая активность
Рис.1. Динамика концентрации протеолитических ферментов (ПФ) в сыворотке крови крыс (метод меченых изотопов йода-123) после их перорального введения. По оси абсцисс – время в часах после приема ПФ; по оси ординат – относительная концентрация (% от введенной дозы/грамм крови) ПФ в сыворотке крови. Синяя линия и квадраты – панкреатин, красная линия и квадраты — амилаза, черная линия и треугольники – трипсин, зеленая линия и крестики – папаин, фиолетовая линия и звездочки – химотрипсин. Из J.Seifert и соавт., 1995.
В обзорной работе G.Lorkowski (2012) суммированы имеющиеся данные по абсорбции ПФ в ЖКТ после их перорального приема, фармакокинетике ПФ и даны возможные объяснения механизмам этих процессов. Ранние исследования абсорбции протеаз у животных были выполнены путем перорального приема ферментных субстратов, меченых радиоактивными изотопами. Другим методом было количественное определение в плазме крови собственной эстеразной активности протеаз в отношении специфических субстратов, например, этилового эфира N-бензолил-L-аргинина (BAEE) как субстрата для трипсина, а этилового эфира N-ацетил-L-тирозина (ATEE) как субстрата для химотрипсина, а уровня гемоглобина – для оценки общей протеолитической активности. Экспериментальные исследования показали, что абсорбция ПФ зависит от множества факторов, среди которых наиболее важным является размер молекулы. В серии экспериментальных работ J.Seifert и соавторов (1990,1995) было показано, что после перорального приема (рис.1) меченых иодом-123 таких ПФ как трипсин, химотрипсин, панкреатин и папаин, наблюдается постепенное нарастание концентрации ПФ в крови, дифференцированное по времени и количественным параметрам в зависимости от конкретного ПФ. Прием панкреатина вызывал наибольший прирост концентрации фермента в сыворотке крови с максимумом в течение часа. В течение последующих 6-и часов происходило плавное снижение его концентрации. Для других ПФ (трипсин, химотрипсин и папаин) максимальная концентрация в сыворотке крови достигалась только к 3-ему часу после перорального применения и была существенно ниже (в 3 и более раз) по сравнению с панкреатином. Характерно, что через 6 часов для всех ферментов уровень их концентрации в крови (в процентном соотношении с их введенной дозой на 1 г крови) был примерно одинаковым.
Детальные количественные характеристики изменений показателей ПФ в крови даны в таблице 2.
Таблица 2. Количественный анализ абсорбции ферментов в кишечнике крыс в сыворотку крови и лимфу (из J.Seifert и соавт., 1990).
|
Фермент |
Доза на прием, мг |
Общий уровень абсорбции, (%)* |
Общий уровень абсорбции (мг) |
Высокомолекулярная часть, (%) |
Низкомолекулярная часть (мг) |
Низкомолекулярная часть (%) |
|
|
Сыворотка |
Лимфа |
||||||
|
Амилаза |
10 |
59 |
5,9 |
77,1 |
73,7 |
4,35-4,55 |
43,5-45,5 |
|
Химотрипсин |
5 |
38,1 |
1,91 |
37,3 |
57,3** |
0,71-1,09 |
14,2-21,9 |
|
Панкреатин |
2,25 |
36,6 |
0,82 |
50,3 |
55,7 |
0,41-0,46 |
18,4-20,3 |
|
Папаин |
5 |
26 |
1,3 |
24,1 |
60,6** |
0,31-0,79 |
6,27-15,8 |
|
Трипсин |
5 |
49,6 |
2,48 |
54.2 |
68.7** |
1,34-1.7 |
26,9-34,1 |
Примечания: * — общий уровень абсорбции рассчитывался как показатель радиоактивности субстрата при приеме внутрь, пониженный за счет остаточной радиоактивности в кишечнике без дифференциации на высокий или низкий молекулярный вес материала. ** — Из-за различий между концентрацией протеаз высокого молекулярного веса в сыворотке и лимфе, расчетное общее количество абсорбированного высокомолекулярного материала ниже.
Абсорбция бромелаина при интрадуоденальном введении в экспериментах на крысах существенно отличалась от таковой других ПФ. Как видно из рис.2, происходит медленное (по сравнению с другими ПФ) нарастание концентрации бромелаина в сыворотке крови и лимфе в течение 4 часов (максимум) и поддержание этих величин до 6-и часов наблюдения. В данной работе уровень абсорбции бромелаина определен в 50% от введенной дозы за 6 часов, при этом 80% составила высокомолекулярная фракция.
Рис.2. Динамика концентрации меченого изотопом йода-125 бромелаина в сыворотке крови (черные ромбы) и лимфе (черные квадраты) крыс после интрадуоденального введения. По оси абсцисс – время в часах после введения. Из J.Seifert и соавт., 1979.
Ограниченный протеолиз
Ограниченный протеолиз на примере инсулина. 1) Препроинсулин (L — лидерный пептид, B — участок 1, C — участок 2, А — участок 3) 2) Спонтанный фолдинг 3) Образование дисульфидного мостика между А и В 4) В результате ограниченного протеолиза лидерный пептид и пептид C отрезаются 5) Конечная молекула
Ограниченный протеолиз — процесс расщепления одной или нескольких пептидных связей в молекуле белка ферментом-протеазой. Ограниченный протеолиз является одной из регуляторных посттрансляционных модификаций. Ограниченный протеолиз может изменять такие свойства белка, как ферментативная активность, способность связываться с другими белками, внутриклеточная локализация.
Примеры ограниченного протеолиза
Ограниченный протеолиз может использоваться клеткой для разных целей:
- для отщепления N- и С-концевых сигнальных последовательностей в процессе внутриклеточного транспорта белка;
- для удаления вспомогательной части полипептидной цепи пробелка, которая помогает формировать правильную третичную структуру (С-пептид в проинсулине);
- для активации предшественников ферментов (пищеварительные ферменты, протеазы свёртывания крови);
- для изменения локализации белка (некоторые цитоплазматические белки переходят в ядро после ограниченного протеолиза: SREBP, NF-κB, YB-1);
- для получения физиологически активных олигопептидов из белка-предшественника (расщепление проопиомеланокортина с образованием эндорфина, адренокортикотропного гормона, α- и γ-меланоцитстимулирующих гормонов и других физиологически активных пептидов);
- разрезание перемычки между доменами белка, при этом домены обычно остаются в контакте друг другом (созревание дифтерийного токсина, формирование фактора пролиферации клеток HCF-1;
- для разделения белковых глобул в полибелках (это характерно для вирусов);
- для получения нескольких изоформ белка (ограниченный протеолиз белков Stat5 и Stat6 приводит к формированию их изоформ, лишённых доменов, активирующих транскрипцию).
Протеолитическое средство для местного применения — 20 лекарственных препаратов
Лекарственная форма: лиофилизат для приготовления раствора для местного и наружного применения
Фармакологическое действие: Протеолитическая активность препарата — 1 тыс.ПЕ/г. Гидролизует белки (альбумин, Hb, эластин, фибрин); при местном применении расщепляет некротизированные …
Показания: Внутриглазное кровоизлияние (различной этиологии и локализации), помутнение стекловидного тела, травматический кератит.
Международное название: Просубтилин (Prosubtiline)
Лекарственная форма: суспензия для наружного применения
Фармакологическое действие: Профезим — комбинированный препарат, оказывает длительное протеолитическое (некролитическое) действие, вызывая гидролиз белков в раневом отделяемом, …
Показания: Гнойные и гнойно-некротические процессы различной этиологии и локализации: вялозаживающие инфицированные раны (в т.ч. послеоперационные), абсцесс, …
Международное название: Рибонуклеаза (Ribonuclease)
Лекарственная форма: лиофилизат для приготовления раствора для инъекций и местного применения
Фармакологическое действие: Ферментный препарат, получаемый из поджелудочной железы крупного рогатого скота. Деполимеризует РНК до кислоторастворимых моно- и олигопептидов. …
Показания: Заболевания дыхательных путей с вязкой трудноотделяемой мокротой (бронхоэктатическая болезнь, абсцессы легких, ателектаз легкого, экссудативный …
Лекарственная форма: лиофилизат для приготовления раствора для внутриполостного и наружного применения
Фармакологическое действие: При местном и внутриполостном применении разжижает вязкий секрет, экссудат и сгустки крови; обладает пониженной чувствительностью к ингибиторам …
Показания: Гнойные раны, пролежни, трофические язвы, абсцессы различной локализации (после вскрытия, удаления нежизнеспособных тканей, тщательного дренирования …
Лекарственная форма: лиофилизат для приготовления раствора для местного и наружного применения
Фармакологическое действие: Протеолитический фермент.
Показания: Гнойные раны, ожоги, трофические язвы, пролежни; вязкая мокрота (трахеит, бронхит и др.).
Международное название: Трипсин (Trypsin)
Лекарственная форма: лиофилизат для приготовления раствора для инъекций и местного применения, лиофилизат для приготовления раствора для местного и наружного применения, салфетки лечебные
Фармакологическое действие: Эндогенный протеолитический фермент. Оптимум действия — при pH 7-9. При местном применении оказывает противовоспалительное, противоожоговое, …
Показания: Заболевания дыхательных путей, эмпиема плевры, экссудативный плеврит, тромбофлебит, пародонтоз (воспалительно-дистрофические формы), остеомиелит, …
Международное название: Трипсин+Химотрипсин (Trypsin+Chymotrypsin)
Лекарственная форма: лиофилизат для приготовления раствора для местного и наружного применения
Фармакологическое действие: Протеолитическое комбинированное средство белковой природы. Получают из поджелудочной железы крупного рогатого скота. При местном и наружном …
Показания: Нагноительные бронхолегочные заболевания (бронхоэктатическая болезнь, абсцесс легкого, ателектаз, экссудативный плеврит). Заболевания ЛОР-органов: …
Международное название: Химотрипсин (Chymotrypsin)
Лекарственная форма: лиофилизат для приготовления раствора для местного и наружного применения
Фармакологическое действие: Протеолитическое средство белковой природы. Получают из поджелудочной железы крупного рогатого скота. При в/м введении оказывает противовоспалительное …
Показания: Тромбофлебит, пародонтоз (воспалительно-дистрофические формы), остеомиелит, гайморит, отит, ирит, иридоциклит, интракапсулярная экстракция катаракты, …
Лекарственная форма: лиофилизат для приготовления раствора для инъекций и наружного применения
Фармакологическое действие: Протеолитическое средство, фермент эластазного действия, получаемый из поджелудочной железы свиней, гидролизует пептиды, преимущественно по связям, прилегающим к остаткам нейтральных аминокислот, растворяет эластин.
Показания: Трофические язвы, пролежни, глубокие ожоги (с наличием поверхностных струпов), ожоги верхних дыхательных путей, отит (в т.ч. острый, гнойный …
2
ТОП-6 польза протеазы
1.Действие протеазы в организме для улучшения пищеварения
Ферменты играют важную роль в нашем пищеварительном здоровье, и правильное пищеварение зависит от протеазных процессов. Они обладают отчетливой способностью разрушать пептидные связи и выделять аминокислоты. Протеазы необходимы для расщепления белков, чтобы они могли перевариваться
Они также расщепляют другие отходы, включая токсины. Это важно для пищеварительной и иммунной функций, поскольку предотвращает токсическую перегрузку, которая может вызвать у нас заболевания
Исследования показывают, что протеолитические ферменты, особенно бромелайн, помогают уменьшить тяжесть симптомов, связанных с воспалительными заболеваниями кишечника. А также язвенным колитом, благодаря их противовоспалительным свойствам.
2.Действие протеазы в организме — способствование поглощению аминокислот
Протеаза позволяет поглощать аминокислоты, которые жизненно необходимы для построения и восстановления тканей. Белок состоит из определенной последовательности аминокислот. Когда протеаза разделяет эти последовательности на части, это позволяет нам использовать аминокислоты для ряда функций организма. Нам необходим оптимальный баланс аминокислот для поддержания гомеостаза в организме. Поскольку они регулируют основные метаболические пути, необходимые для роста, поддержания иммунитета и репродукции.
3.Действие протеазы в организме — повышает иммунную функцию
Протеазные ферменты увеличивают активность естественных клеток-киллеров и разрушают патогенные комплексы, способные снижать нормальную иммунную функцию. Исследования показывают, что папаин, трипсин и другие протеазы могут предотвращать или разрушать существующие патогенные иммунные комплексы. Тем самым усиливая лимфодренаж и укрепляя иммунную систему.
Патогенные комплексы являются нормальной частью иммунной системы. Однако, когда они возникают в избытке, то могут вызывать определенные заболевания. В том числе заболевания почек, ревматологические заболевания и воспаления нервов.
4.Действие протеазы в организме — предотвращает образование тромбов и атеросклероз
Протеаза улучшает качество наших клеток крови. Эти ферменты ответственны за образование и растворение сгустков крови. Они также обладают антикоагулянтным, противовоспалительным и антигипертензивным действием.
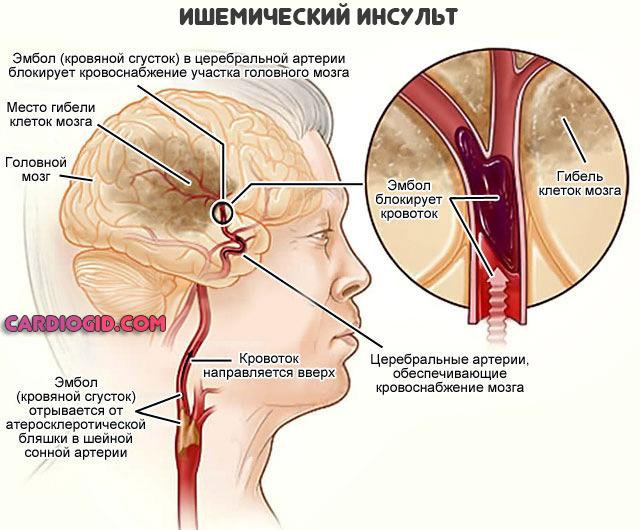
Протеазные добавки были разработаны и используются для лечения тромботических заболеваний с 1970-х годов. Папаин, протеаза, найденная в папайях, может помочь предотвратить утолщение кровеносных сосудов, заболевание сердца, называемое атеросклерозом. Бромелайн, протеаза, содержащаяся в ананасе, обладает антикоагулянтными свойствами и может снизить риск образования тромбов. Они приводят к таким опасным осложнениям, как ишемическая болезнь сердца, легочная эмболия и инсульт.
5.Действие протеазы в организме — ускоряет восстановление тканей
С древних времен протеазы использовались для содействия восстановлению тканей. Согласно научному обзору, опубликованному в журнале «Advances in Therapy»
«Трипсин и химотрипсин помогают уменьшить воспаление и способствуют более быстрому восстановлению острого повреждения ткани»
Комбинация этих ферментов обычно используется в оральных протеолитических ферментных добавках для восстановления травматических, хирургических и ортопедических повреждений. Наряду с их противовоспалительными эффектами, ферменты протеазы также работают как антиинфекционные, антиоксидантные, анти-сгусток крови и противоотечные агенты.
6.Действие протеазы в организме — помогает предотвратить рак толстой кишки
Исследования показывают, что протеазы, содержащиеся в некоторых продуктах (например, папайя) способны связываться с канцерогенными токсинами в толстой кишке. Они удерживают их вдали от здоровых клеток толстой кишки. Согласно исследованиям, опубликованным в Мировом журнале гастроэнтерологии, ферменты протеазы участвуют в деградации раковой инвазии и метастазировании. Исследователи указывают, что протеазы служат потенциальными целевыми молекулами для терапевтических агентов при лечении колоректального рака.
I. Растительные протеазы.
Протеазы дынного дерева
В соответствии с данными А.М.Пенджиева и А.Абдуллаева (2017) «высушенный млечный сок (латекс) дынного дерева содержит ряд протеаз: Папаин – монотиоловая цистеиновая эндопротеаза. По характеру ферментативного действия ее называют «растительным пепсином»
Но, в отличие от пепсина, папаин активен не только в кислых, но и в нейтральных и щелочных средах (диапазон рН 3–12, оптимум рН=5), что важно при часто встречающихся у спортсменов нарушениях кислотного состава желудка. Химопапаин – монотиоловая цистеиновая протеиназа
Благодаря субстратной специфичности похожа на папаин, но отличается от него электрофоретической подвижностью, стойкостью и растворимостью. Протеиназа IV – цистеиновая протеиназа, основная протеиназа латекса, составляет около 30 % присутствующего в нем белка. Проявляет высокую степень гомологии с протеиназой III папайи (81 %), химопапаином (70 %) и папаином (67 %). Очень близка к химопапаину по молекулярной массе и заряду молекулы. Карикаин – наиболее щелочная среди цистеиновых протеиназ латекса папайи. Подобно папаину, карикаин сначала продуцируется в форме неактивного зимогена прокарикаина, содержащего ингибиторный прорегион из 106 N-терминальных аминокислот. Активация фермента заключается в отщеплении прорегиона молекулы без ее последующих конформационных изменений. Протеиназа w (эндопептидаза А, пептидаза А) – монотиоловая цистеиновая протеиназа. Это полипептид, содержащий 216 аминокислотных остатков и 3 дисульфидные связи. Для проявления его ферментативной активности важно наличие свободного остатка цистеина в активном центре. Проявляет высокую степень гомологии с папаином (68,5 %). По специфичности ферментативного действия напоминает папаин, поскольку связывается с субстратом в участках локализации дисульфидных связей. Для стабилизации комплекса протеиназ папайи с практическими целями используются специальные полимеры, разработанные еще во времена существования СССР.
Протеазы ананаса
Физико-химические свойства основной комплексной смеси протеолитических ферментов ананаса – бромелаина, — и применение его в клинических условиях, подробно описаны в нескольких обзорах последнего времени (H.R.Maurer, 2001; В.К.Bhattacharyya, 2008; R.Pavan и соавт., 2012; V.Rathnavelu и соавт., 2016), выполненных в научных лабораториях стран — мест произрастания и высокотехнологичной переработки ананаса (в основном, Индии). Бромелаин представляет собой водный экстракт из плодов необработанного ананаса. Это смесь различных тиоловых эндопептидаз и ряда других активных веществ, например фосфатаз, глюкозидаз, пероксидаз, целлюлаз, гликопротеинов, углеводов и некоторых ингибиторов протеаз (В.К.Bhattacharyya, 2008). При этом бромелаин, получаемый из стеблей ананаса отличается по составу от такового из плодов ананаса. Как и в случае папаина, ферментативная активность бромелаина сохраняется в широком диапазоне изменений рН – от кислой до щелочной – 5,5 – 8,0 (S.Yoshioka и соавт., 1991). В настоящее время бромелаин производят из охлажденного ананасового сока путем центрифугирования, ультрафильтрации и лиофилизации. Ферментативная активность получаемого порошка определяется эмпирически на таких белковых субстратах как казеин (FIP-единицы), желатин (единицы переваривания желатина) или хромогенные трипептиды (H.R.Maurer, 2001).
Функции панкреатических ферментов в организме – исторические факты
Панкреатические ферменты используются в медицине для лечения экзокринной недостаточности поджелудочной железы и других расстройств пищеварения с 1800-х годов. Сегодня Всемирная организация здравоохранения считает, что
«Панкреатические ферменты являются безопасными и необходимыми лекарственными средствами для предотвращения недоедания у некоторых пациентов»
В 2006 году FDA изменило способ продажи продуктов замены панкреатических ферментов (PERT) в Соединенных Штатах. FDA требовало от фармацевтических компаний с продуктами PERT, полученными из свинины, подавать новые заявки на лекарства для каждого продукта. Это прежде, чем они могли быть доступны для потребителей. Были выпущены Стратегия оценки и смягчения рисков (REMS) и Руководства по лекарственным препаратам. Необходимо было убедиться, что продукты PERT, полученные из свинины, были безопасными и эффективными.
С тех пор на рынке появилось шесть продуктов марки PERT. Считается, что они безопасны для беременных женщин и могут спасти жизнь людям с серьезными нарушениями пищеварения.
Функция и механизм
Протеазы вовлечены в переваривание длинных цепей белка в более короткие фрагменты, разделив связи пептида та аминокислота связи остатки. Некоторые отделяют предельные аминокислоты от цепи белка (exopeptidases, такие как aminopeptidases, carboxypeptidase A); другие нападают на внутренние узы пептида белка (endopeptidases, такие как трипсин, chymotrypsin, пепсин, папаин, elastase).
Катализ
Катализ достигнут одним из двух механизмов:
- Аспарагиновая кислота, глутаминовая кислота и протеазы мета-Лло активируют молекулу воды, которая выполняет нуклеофильное нападение на связь пептида, чтобы гидролизировать его.
- Серин, треонин и протеазы цистеина используют нуклеофильный остаток в (обычно в каталитической триаде). Тот остаток выполняет нападение nucleophilc, чтобы ковалентно связать протеазу с белком основания, выпуская первую половину продукта. Это ковалентное промежуточное звено acyl-фермента тогда гидролизируется активированной водой, чтобы закончить катализ, выпуская вторую половину продукта и восстанавливая бесплатный фермент.
Специфика
Proteolysis может быть очень разнородный таким образом, что широкий диапазон оснований белка гидролизируется. Дело обстоит так для пищеварительных ферментов, таких как трипсин, которые должны быть в состоянии расколоть множество белков, глотал в меньшие фрагменты пептида. Разнородные протеазы, как правило, связывают с единственной аминокислотой на основании, и поэтому только имейте специфику для того остатка. Например, трипсин определенный для последовательностей… K\… или… R\… (‘ \’= место раскола).
С другой стороны некоторые протеазы очень определенные и только раскалывают основания с определенной последовательностью. Свертывание крови (такое как тромбин) и вирусная обработка полибелка (такая как протеаза TEV) требует этого уровня специфики, чтобы достигнуть точных событий раскола. Это достигнуто протеазами, раскалывающими долгое закрепление или тоннель с несколькими карманами вдоль него, которые связывают указанные остатки. Например, протеаза TEV определенная для последовательности… ENLYFQ\S… (‘ \’= место раскола).
Деградация и автолиз
Протеазы, будучи собой белки, расколоты другими молекулами протеазы, иногда того же самого разнообразия. Это действует как метод регулирования деятельности протеазы. Некоторые протеазы менее активны после автолиза (например, протеаза TEV), пока другие более активны (например, trypsinogen).
Что такое панкреатические ферменты? В чем заключаются функции панкреатических ферментов в организме?
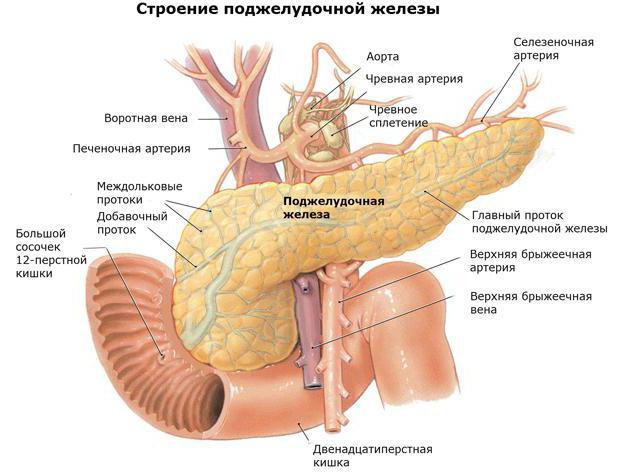
Поджелудочная железа выделяет пищеварительный «сок», который состоит из двух продуктов: пищеварительных ферментов и бикарбоната. Бикарбонат помогает нейтрализовать желудочную кислоту и делает поджелудочную железу более щелочной.
Все ферменты являются катализаторами, которые позволяют молекулам переходить из одной формы в другую. Пищеварительные ферменты — это вещества, которые выделяются организмом, чтобы помочь превратить более крупные молекулы в более мелкие. В качестве крупных и мелких молекул выступают макроэлементы, которые мы называем белками, углеводами и жирами. В дополнение к пищеварительным ферментам желчь и соляная кислота также помогают с пищеварением.
В организме человека насчитывается более 2700 различных типов ферментов, и каждый из них играет свою уникальную роль. Большинство пищеварительных ферментов производится в поджелудочной железе, хотя они также вырабатываются и в других частях пищеварительной системы. У нас есть разные ферменты для расщепления различных типов молекул, содержащихся в продуктах, включая белки, жиры. А также углеводы, волокна и кислоты. По данным Сети по борьбе с раком поджелудочной железы:
«Нормально функционирующая поджелудочная железа ежедневно выделяет около 8 стаканов панкреатического сока в двенадцатиперстную кишку»
Какие существуют три фермента поджелудочной железы? Основные категории ферментов, вырабатываемых поджелудочной железой, включают:
- амилазу — расщепляет крахмал/углеводы;
- протеазу — расщепляет белково-пептидные связи;
- липазу — расщепляет жиры
Есть и другие пищеварительные ферменты, которые играют уникальную роль. Это рибонуклеазу, дезоксирибонуклеазу, желатиназу, фитазу, пектиназу, лактазу, мальтозу и сахарозу. Они помогают расщеплять такие вещества, как желатин, сахар, содержащийся в молоке, фитиновой кислоте. А также других сахарах, таких как сахароза и мальтоза.
Что такое протеаза? Определение протеазы и роль в организме
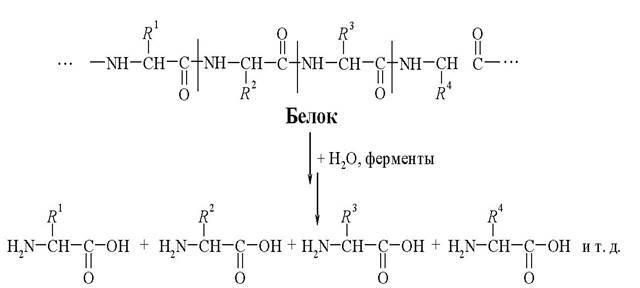
Протеазы были названы биологической версией швейцарских армейских ножей, способных разрезать длинные последовательности белков на фрагменты. Протеаза — это фермент, который расщепляет длинные, цепочечные молекулы белков, чтобы они могли перевариваться. Этот процесс называется протеолизом. Он превращает белковые молекулы в более короткие фрагменты, называемые пептидами, а в конечном итоге в их компоненты, называемые аминокислотами. Нам нужен постоянный запас аминокислот для правильного роста и восстановления.
Белки — жесткая, сложная, свернутая структура, и их можно разбить или разобрать только с помощью ферментов протеазы. Процесс переваривания белков начинается в желудке, где соляная кислота раскрывает белки, а фермент пепсин начинает их разбирать. Поджелудочная железа выделяет ферменты протеазы (главным образом, трипсин). А в кишечнике они разрывают белковые цепи на более мелкие кусочки. Затем ферменты на поверхности и внутри кишечных клеток разрушают кусочки еще больше. Они превращают их в аминокислоты, которые готовы к употреблению во всем организме.
Когда эти ферменты протеазы не присутствуют в организме для расщепления белковых молекул, кишечная оболочка не сможет их переварить. Это может привести к серьезным проблемам со здоровьем.
Протеазы вырабатываются поджелудочной железой, а также обнаруживаются в некоторых фруктах, бактериях и других микробах. Пищеварительный тракт продуцирует три различных формы протеазы: трипсиноген, химотрипсиноген и прокарбоксипептидазу. Эти три протеазы атакуют разные пептидные связи, что позволяет генерировать аминокислоты, строительные блоки белка.
В чем заключается действие протеазы в организме? Практически во всем! Эти ферменты обеспечивают правильную работу нашей пищеварительной и иммунной систем, почек, печени, селезенки, поджелудочной железы и кровотока. Протеаза играет роль в регулировании метаболической функции и позволяет витаминам и минералам, которые мы принимаем, работать должным образом. И, кроме того, протеазы необходимы для нормального функционирования гормонов и способствуют восстановлению мышц и заживлению тканей.
Специфичность
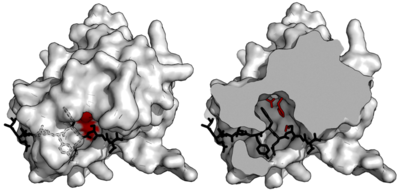
Естественная последовательность расщепления была сначала определена путем изучения участков разрезания в нативном полипротеиновом субстрате для повторяющейся последовательности. Консенсусной последовательностью нативного сайта расщепления является ENLYFQ\S (где ‘\’ обозначает расщепляемую пептидную связь). Аминокислотные остатки субстрата нумеруются с Р6 по Р1 до сайта расщепления и Р1’ после вырезанного участка. В ранних работах также проводили оценку расщепления массива схожих субстратов, чтобы определить насколько специфично фермент будет расщеплять нативную последовательность.
В исследованиях впоследствии применялось секвенирование расщепляемых субстратов из пула рандомизированных последовательностей для определения предпочтительных паттернов. Хотя ENLYFQ\S — это оптимальная последовательность, протеаза активна в большей или меньшей степени на различных субстратах (т. е. проявляет некоторую вариабельность). Наиболее эффективное расщепление происходит в последовательностях наиболее похожих на консенсус EXLYΦQ\φ, где X — любой аминокислотный остаток, Φ — любой большой или гидрофобный остаток среднего размера, а φ — любой небольшой гидрофобный или полярный аминоктслотный остаток.
Специфичность обеспечивается большой площадью контакта между ферментом и субстратом. Протеазы, такие как трипсин, специфичны для одного аминокислотного остатка до и после расщепляемой связи за счет мелкой связывающей щели только с одним или двумя карманами, которые связывают боковые цепи субстрата. И наоборот, вирусные протеазы, такие как TEV-протеаза, имеют длинный C-концевой хвост, который полностью закрывает субстрат для создания связывающего тоннеля. Этот туннель содержит набор связывающих карманов, так что каждая боковая цепь пептидного субстрата (с Р6 до Р1’) связывается с комплиментарным сайтом (с С6 до С1’).
В частности, пептидная боковая цепь P6-Glu контактирует с сетью из трех водородных связей; P5-Asn указывает на растворитель, не создавая специфичных взаимодействий (по этой причине отсутствует консенсус в последовательности субстрата в данном положении); P4-Leu погружает в гидрофобный карман; P3-Tyr удерживает в гидрофобном кармане с короткой водородной связью в конце; P2-Phe также окружен гидрофобнымими остатками, включая поверхность триады гистидина; P1-Gln образует четыре водородные связи; и P1′-Ser только частично заключен в мелкую гидрофобную канавку.
Ферменты поджелудочной железы. Источники и дозировки
Поджелудочная железа вырабатывает ферменты, чтобы переваривать пищу, которую мы употребляем. Однако ферменты также могут быть получены с использованием ферментных добавок. Ферменты поджелудочной железы — это искусственные смеси ферментов, естественным образом вырабатывающиеся поджелудочной железой: амилаза, липаза и протеаза.
В форме дополнения эти смеси иногда называют панкрелипазой и панкреатином. Они принимаются, чтобы помочь расщеплять жиры, белки и углеводы, когда в организме не производится достаточное количество ферментов.
Добавки панкреатического фермента получают из растительных и животных источников, в том числе папайи, ананаса и домашнего скота. Одним из примеров панкреатических ферментов являются протеолитические ферменты, которые переваривают белок, расщепляя его на аминокислоты. Протеолитические ферменты обычно получают из папайи.
Доступны как рецептурные, так и безрецептурные панкреатические ферменты.
Какова рекомендуемая дозировка для панкреатических ферментов?
- Дозировка ферментов, подходящая для каждого человека, зависит от таких факторов, как история болезни и вес тела. Вы должны начать с наименьшей необходимой дозы и скорректировать в соответствии с вашей реакцией и тяжестью недостаточности поджелудочной железы.
- Ферменты поджелудочной железы обычно дозируются в соответствии с единицами липазы, содержащимися в продукте. Всегда внимательно читайте инструкции, так как в зависимости от марки рекомендуется принимать разные дозы.
- Для взрослых рекомендуется начинать прием ферментов поджелудочной железы в дозах 10 000–20 000 единиц липазы с небольшими порциями пищи/закусками. Либо между 20 000–40 000 единиц липазы с основным приемом пищи.
- Из-за возможной негативной реакции не рекомендуется превышать 2500 единиц липазы на килограмм веса организма за прием пищи. Это означает, что мужчинам или женщинам, вес которых 68 кг, не следует принимать более 170 000 единиц липазы за прием пищи.
- Принимайте ферменты до еды. Ферментные капсулы можно принимать внутрь или открывать, чтобы смешать содержимое с чем-то вроде яблочного пюре. Смешивание ферментов напрямую с какой-либо щелочной пищей может привести к их инактивации.
- Обязательно храните ферментные продукты в сухом прохладном месте. Избегайте их увлажнения, так как это может изменить их работу. Проверяйте срок годности перед употреблением.
Если вы принимаете рецептурные панкреатические ферменты (подробнее об этом ниже), то ваша доза будет определяться врачом. Поскольку потребности в дозировке могут изменяться по мере того, как организм приспосабливается к препарату. Продолжайте обсуждать любые проблемы или реакции, которые у вас возникают с лечащим врачом.
Если вы решили принимать безрецептурные панкреатические ферменты, рекомендуем рассмотреть следующие варианты:
- Now Foods, Панкреатин, 10X — 200 мг, 250 капсул
- Enzymatic Therapy, Мега-Зим, Системные ферменты, 200 таблеток
- Thorne Research, Бетаингидрохлорид и пепсин, 225 капсул
- Wobenzym N, Здоровье суставов, 400 таблеток с оболочкой