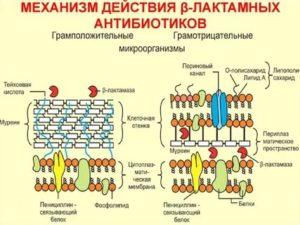
Ингибиторы ферментов и их использование в качестве лечебных препаратов
Содержание:
- Использование в медицине
- Обратимое ингибирование
- Обратимое ингибирование
- Ингибиторы протеолитических ферментов (протеаз)
- Кинетические зависимости ферментативной реакции при участии конкурентного ингибитора
- Ингибиторы АПФ – показания к применению
- Показания
- БИОХИМИЯ — Л. Страйер — 1984
- ГЛАВА 6. ВВЕДЕНИЕ В ЭНЗИМОЛОГИЮ
Использование в медицине
На механизме конкурентного ингибирования основано действие многих лекарственных препаратов, представляющих собой структурные аналоги субстратов некоторых метаболических путей, торможение которых является необходимой частью лечения заболеваний.
Например, для улучшения проводимости нервных импульсов при мышечных дистрофиях требуется повысить уровень ацетилхолина. Это достигается угнетением активности гидролизующей его ацетилхолинэстеразы. В роли ингибиторов выступают четвертичные аммониевые основания, входящие в состав лекарственных препаратов (прорезин, эндрофоний и т. д.).
В особую группу выделяют антиметаболиты, которые помимо ингибирующего действия проявляют свойства псевдосубстрата. В таком случае формирование комплекса EI приводит к образованию биологически инертного аномального продукта. К антиметаболитам относят сульфаниламиды (используются при лечении бактериальных инфекций), аналоги нуклеотидов (применяются для остановки клеточного роста раковой опухоли) и т. д.
Обратимое ингибирование
Конкурентное ингибирование
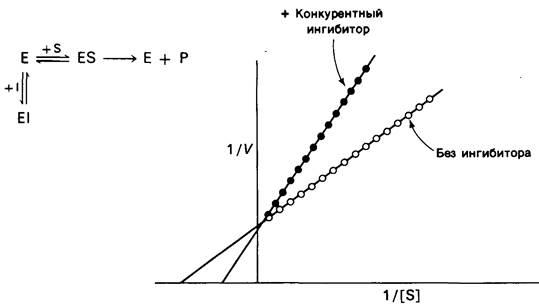
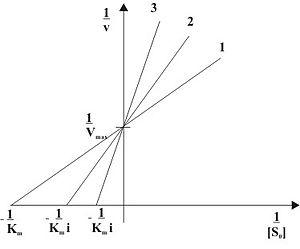 Рис. 2: Конкурентное ингибирование при различных концентрациях ингибитора в двойных обратных координатах ( 1 … =0, 2 … >0, 3 … >2)
Рис. 2: Конкурентное ингибирование при различных концентрациях ингибитора в двойных обратных координатах ( 1 … =0, 2 … >0, 3 … >2)
В этом случае ингибитор связывается в активном центре фермента и конкурирует за него с субстратом. Таким образом, конкурентный ингибитор не связывается с фермент-субстратным комплексом (ES на рис.1), то есть константа диссоциации Ki‘ >> 1.
Конкурентный ингибитор обычно структурно схож с субстратом, однако фермент не способен катализировать реакцию в присутствии ингибитора из-за отсутствия у последнего необходимых функциональных групп.
Схема конкурентного ингибирования и уравнение Михаэлиса-Ментен для него выглядят следующим образом:
|
|
Видно, что при конкурентном ингибировании максимальная скорость реакции Vmax не меняется, а кажущаяся константа Михаэлиса увеличивается в (1 + [I]/Ki) раз.
Поэтому в двойных обратных координатах Лайнуивера-Берка (зависимость 1/v от 1/[S]) при разных концентрациях ингибитора получают семейство прямых с различным наклоном, пересекающихся в одной точке на оси ординат.
Константу ингибирования Ki обычно определяют так: проводят ряд измерений кажущейся константы Михаэлиса при различных концентрациях ингибитора, затем строят зависимость этой величины от концентрации ингибитора. Тангенс угла наклона полученной прямой равен Km/Ki.
Неконкурентное ингибирование
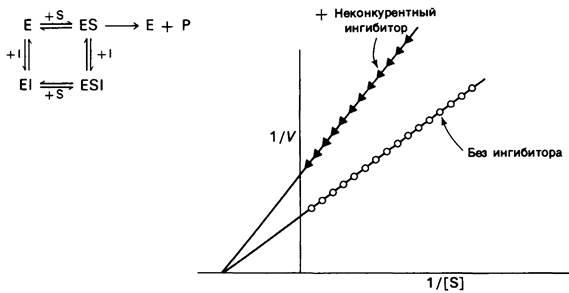
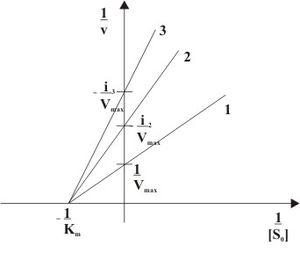 Рис. 3: Неконкурентное ингибирование в двойных обратных координатах при различных концентрациях ингибитора ( 1 … =0, 2 … >0, 3 … >2)
Рис. 3: Неконкурентное ингибирование в двойных обратных координатах при различных концентрациях ингибитора ( 1 … =0, 2 … >0, 3 … >2)
Неконкурентный ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу с одинаковой эффективностью. Ингибитор вызывает такие конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату.
Схема и уравнение Михаэлиса-Ментен в случае неконкурентного ингибирования:
|
|
При неконкурентном ингибировании константа Михаэлиса не изменяется, а максимальная скорость реакции уменьшается в (1 + [I]/Ki) раз. Поэтому в двойных обратных координатах семейство прямых, отвечающих разным концентрациям ингибитора, пересекается в одной точке на оси абсцисс.
Бесконкурентное ингибирование
При бесконкурентном ингибировании ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом. Субстрат, связываясь с ферментом, изменяет его конформацию, что делает возможным связывание с ингибитором. Ингибитор, в свою очередь, так меняет конформацию фермента, что катализ становится невозможным.
Схема и уравнение Михаэлиса-Ментен в случае бесконкурентного ингибирования:
|
E+S⟶ES⟶E+P{\displaystyle E+S\longrightarrow ES\longrightarrow E+P} |
|
Максимальная скорость реакции и кажущаяся константа Михаэлиса уменьшаются в одинаковое число раз. Поэтому в двойных обратных координатах для разных концентраций ингибитора получаем семейство параллельных прямых.
Ингибирование субстратом
Ингибирование субстратом — частный случай бесконкурентного ингибирования, когда две молекулы субстрата связываются с ферментом, что препятствует образованию продукта.
Схема и уравнение Михаэлиса-Ментен в случае ингибирования субстратом:
|
E+S⟶ES⟶E+P{\displaystyle E+S\longrightarrow ES\longrightarrow E+P} |
|
Обратимое ингибирование
Конкурентное ингибирование
 Рис. 2: Конкурентное ингибирование при различных концентрациях ингибитора в двойных обратных координатах ( 1 … =0, 2 … >0, 3 … >2)
Рис. 2: Конкурентное ингибирование при различных концентрациях ингибитора в двойных обратных координатах ( 1 … =0, 2 … >0, 3 … >2)
В этом случае ингибитор связывается в активном центре фермента и конкурирует за него с субстратом. Таким образом, конкурентный ингибитор не связывается с фермент-субстратным комплексом (ES на рис.1), то есть константа диссоциации Ki‘ >> 1.
Конкурентный ингибитор обычно структурно схож с субстратом, однако фермент не способен катализировать реакцию в присутствии ингибитора из-за отсутствия у последнего необходимых функциональных групп.
Схема конкурентного ингибирования и уравнение Михаэлиса-Ментен для него выглядят следующим образом:
|
|
Видно, что при конкурентном ингибировании максимальная скорость реакции Vmax не меняется, а кажущаяся константа Михаэлиса увеличивается в (1 + [I]/Ki) раз.
Поэтому в двойных обратных координатах Лайнуивера-Берка (зависимость 1/v от 1/[S]) при разных концентрациях ингибитора получают семейство прямых с различным наклоном, пересекающихся в одной точке на оси ординат.
Константу ингибирования Ki обычно определяют так: проводят ряд измерений кажущейся константы Михаэлиса при различных концентрациях ингибитора, затем строят зависимость этой величины от концентрации ингибитора. Тангенс угла наклона полученной прямой равен Km/Ki.
Неконкурентное ингибирование
 Рис. 3: Неконкурентное ингибирование в двойных обратных координатах при различных концентрациях ингибитора ( 1 … =0, 2 … >0, 3 … >2)
Рис. 3: Неконкурентное ингибирование в двойных обратных координатах при различных концентрациях ингибитора ( 1 … =0, 2 … >0, 3 … >2)
Неконкурентный ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу с одинаковой эффективностью. Ингибитор вызывает такие конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату.
Схема и уравнение Михаэлиса-Ментен в случае неконкурентного ингибирования:
|
|
При неконкурентном ингибировании константа Михаэлиса не изменяется, а максимальная скорость реакции уменьшается в (1 + [I]/Ki) раз. Поэтому в двойных обратных координатах семейство прямых, отвечающих разным концентрациям ингибитора, пересекается в одной точке на оси абсцисс.
Бесконкурентное ингибирование
При бесконкурентном ингибировании ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом. Субстрат, связываясь с ферментом, изменяет его конформацию, что делает возможным связывание с ингибитором. Ингибитор, в свою очередь, так меняет конформацию фермента, что катализ становится невозможным.
Схема и уравнение Михаэлиса-Ментен в случае бесконкурентного ингибирования:
|
E+S⟶ES⟶E+P{\displaystyle E+S\longrightarrow ES\longrightarrow E+P} |
|
Максимальная скорость реакции и кажущаяся константа Михаэлиса уменьшаются в одинаковое число раз. Поэтому в двойных обратных координатах для разных концентраций ингибитора получаем семейство параллельных прямых.
Ингибирование субстратом
Ингибирование субстратом — частный случай бесконкурентного ингибирования, когда две молекулы субстрата связываются с ферментом, что препятствует образованию продукта.
Схема и уравнение Михаэлиса-Ментен в случае ингибирования субстратом:
|
E+S⟶ES⟶E+P{\displaystyle E+S\longrightarrow ES\longrightarrow E+P} |
|
Ингибиторы протеолитических ферментов (протеаз)
Ингибиторы протеолитических ферментов (протеаз)
Ингибиторы протеаз (апротинин) – ЛС, подавляющие активность протеолитических ферментов поджелудочной железы (трипсин, химотрипсин) и других протеаз крови и тканей (плазмин, калликреин и др.).
Подавление активности панкреатических ферментов необходимо при заболеваниях, сопровождающихся их активацией в тканях поджелудочной железы, которая может возникать вследствие нарушений проходимости протоков поджелудочной железы, например, остром панкреатите, обострении хронического панкреатита, травмах или раке поджелудочной железы, отеке стенки двенадцатиперстной кишки после приема алкоголя и т. д. В этих условиях активируется фермент цитокиназа, стимулирующая переход протеолитических ферментов из неактивной формы (трипсиноген) в активную (трипсин), не в просвете кишечника, а в самой железе, что приводит к «самоперевариванию» поджелудочной железы и окружающих тканей. Одновременно увеличивается образование кининов (брадикинина в плазме крови и калликреина в тканях), вызывающих нарушение микроциркуляции в железе, вазодилятацию и повышение проницаемости сосудов, в результате которых развивается отек железы с очаговыми кровоизлияниями. По причине нарушения оттока в двенадцатиперстную кишку часть активных панкреатических ферментов (трипсин и липаза) попадает в кровь, и вызывает развитие коллапса, лейкоцитоза, анемии, геморрагии, поражение капилляров, нарушение свертываемости крови, а также жировые некрозы и плевриты. Из-за высокой интоксикации у таких пациентов возможен летальный исход.
Механизм действия
Ингибиторы протеаз инактивируют циркулирующие в крови трипсин, плазмин и другие протеазы, устраняют токсемию, блокируют свободные кинины и, тем самым, предупреждают прогрессирование деструктивного процесса в поджелудочнойжелезе, неконролизуемый фибринолиз и другие тяжелые осложнения. Блокада плазмина, на фоне применения данных препаратов понижает фибринолитическую активность крови, тормозит фибринолиз и приводит к повышению свертываемости крови.
Показания
Панкреатит (острый и обострение хронического), панкреонекроз, профилактика послеоперационного панкреатита; кровотечения, связанные с повышенным фибринолизом, коагулопатии (в настоящий момент применение препарата по данному показанию ограничено в связи с высоким риском возникновения серьезных нежелательных реакций).
Нежелательные реакции
Повышение риска развития инфаркта миокарда (особенно при использовании высоких доз препарата), психотические реакции, галлюцинации, тромбозы, тромбофлебит и др.
Оглавление книги
Кинетические зависимости ферментативной реакции при участии конкурентного ингибитора
Конкурентное ингибирование увеличивает константу Михаэлиса (Km), которая равна концентрации субстрата, необходимой для достижения ½ максимальной скорости катализа в начале реакции. Количество фермента, гипотетически способного связаться с субстратом, остается постоянным, а число фактически образующихся ES-комплексов зависит только от концентрации последнего (комплексы EI не постоянны и могут быть вытеснены субстратом).
Конкурентное ингибирование ферментов легко определить по графикам кинетической зависимости, построенным для разных концентраций субстрата. В этом случае величина Km будет меняться, а Vmax оставаться постоянной величиной.

При неконкурентном ингибировании все наоборот: ингибитор связывается вне активного центра и присутствие субстрата никак не может на это повлиять. В результате часть молекул фермента «выключается» из катализа, и максимально возможная скорость снижается. Тем не менее активные молекулы энзима могут беспрепятственно связываться с субстратом как при маленькой, так и при высокой концентрации последнего. Следовательно, константа Михаэлиса остается постоянной.

Графики конкурентного ингибирования в системе двойных обратных координат представляют собой несколько прямых, пересекающих ось ординат в точке 1/Vmax. Каждая прямая соответствует определенной концентрации субстрата. Разные точки пересечения с осью абсцисс (1/) говорят об изменении константы Михаэлиса.
Ингибиторы АПФ – показания к применению
Применение данных лекарств необходимо, прежде всего, людям, имеющим:
- хроническую сердечную недостаточность;
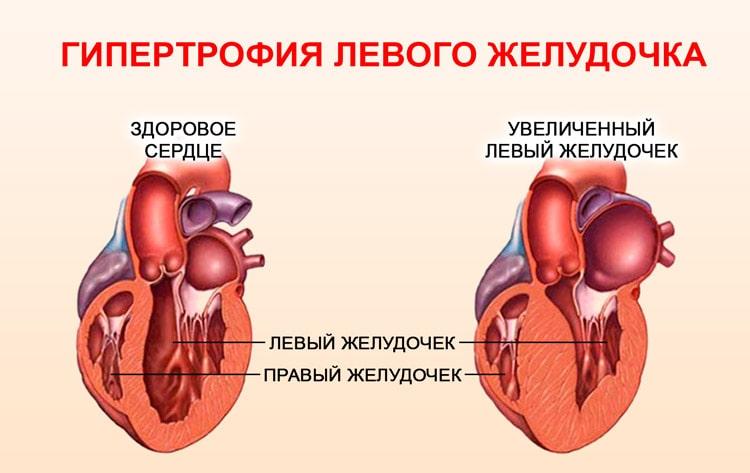
- нарушение работы левого желудочка;
- диабетическую нефропатия;
- пережившим сердечный приступ.
Отсутствие назначения перечисленным категория пациентов связано с плохим прогнозом. Такие показания называют абсолютными.
Назначение иАПФ обосновано, но необязательно при:
- стабильной ишемической болезни сердца (ИБС), особенно если есть абсолютные показания;
- инфаркте миокарда;
- системном атеросклерозе;
- нарушении работы почек недиабетического происхождения;
- выраженном атеросклеротическом поражении сосудов сердца.
Инфаркт миокарда
Назначение ингибиторов АПФ больным, пережившим сердечный приступ, позволяет существенно сократить уровень летальности (1). Доказано, что особо важны препараты при наличии у пациента нарушений работы левого желудочка, явной/скрытой сердечной недостаточности.
Большинство людей начинают принимать блокаторы АФП с 3-10 дня. Это позволяет предупредить резкое падение артериального давления, развитие осложнений. Более раннее назначение обосновано у больных с крупноочаговым инфарктом передней стенки, рецидивом сердечного приступа.
Минимальная продолжительность курса лечения – 6 месяцев.
Артериальная гипертония
Ингибиторы АПФ — одна из 5 групп препаратов первой линии для борьбы с гипертензией. Это значит, что они подходят подавляющему количеству больных, рекомендуются к приему при данном диагнозе в первую очередь. Лекарства назначают пациентам, имеющим абсолютные показания.
Обычно препараты принимают вместе с гипотензивными средствами других групп. Наиболее действенные комбинации – иАПФ + тиазидные/тиазидоподобные диуретики/антагонисты кальция. Изолированное лечение применяется редко из-за низкой эффективности: добиться стойкого снижения АД удается только 50% пациентам. При сочетании гипертонии и гиперхолестеринемии пациентам назначают комплексные лекарства, которые кроме гипотензивных компонентов содержат статины.
Список лучших комбинированных препаратов
| Действующее вещество | Торговое название |
|---|---|
| Амлодипин + Аторвастатин + Периндоприл | Липертанс |
| Амлодипин + Лизиноприл + Розувастатин | Эквамер |
| Амлодипин + Лизиноприл |
|
| Амлодипин + Рамиприл |
|
| Гидрохлоротиазид + Лизиноприл* |
|
| Гидрохлоротиазид + Эналаприл |
|
Артериальное давление на фоне приема препаратов снижается не сразу. Максимального результата достигают за 2-4 недели. Существует 2 варианта реакции организма пациента на прием таблеток, зависящих от активности ренина.
| Степень активности ренина | Реакция АД |
|---|---|
| Высокая | 3 фазы:
|
| Нормальная/низкая | Постепенное снижение |
Сахарный диабет
Больные сахарным диабетом находятся в группе риска развития диабетической нефропатии, хронической почечной недостаточности. Применение ингибиторов АПФ позволяет его сократить. При высоком уровне креатинина (более 300 мкмоль/л) их рекомендуют комбинировать с петлевыми диуретиками, антагонистами кальция. Это помогает предотвратить развитие нежелательных реакций.
Лекарства данной группы назначаются даже людям, имеющим нормальное артериальное давление, если у них есть признаки поражения почек – выделение с мочой альбуминов (альбуминурия).
На начальной стадии назначения гипотензивных лекарств необходимо более тщательно контролировать концентрацию сахара крови. Это требование объясняется влиянием ингибиторов АПФ на механизм усвоения глюкозы. Препарат повышает чувствительность тканей к инсулину, что способствует усвоению сахара. Это может спровоцировать гипогликемию (низкий уровень глюкозы).
Показания
Основания для применения ингибиторов АПФ разнообразны. Главным безусловно является артериальная гипертензия любого происхождения.
Эффект будет неодинаковым, потому как причину сужения сосуда могут быть разными, биохимическая составляющая с выработкой ангиотензина из ренина присутствует всегда, но роль во всех ситуациях отлична.
Помимо, можно назвать следующие показания к использованию:
Инфаркт миокарда в острой фазе. Средства способствуют снижению скорости деструкции кардиальных тканей, что уменьшает общую площадь и обширность поражения структур сердца. Эффект уже описывался выше.

Коронарная недостаточность, перенесенная в недавнем прошлом. То есть состояние после инфаркта. Суть та же, ингибиторы АПФ снижают риски развития рецидива.
Инсульт ишемического типа. Отмирание мозговых тканей, церебральных структур без нарушения целостности сосудов.
Ингибиторы АПФ используются для нормализации артериального давления, которое почти всегда повышается на фоне неотложного состояния.
Но врачи внимательно следят за жизненно важным показателем. Потому как возможна нестабильность уровня АД.
Ишемическая болезнь сердца. Кардиальная недостаточность в любой фазе. Для превенции инфаркта.
Хроническая почечная дисфункция.
Внимание:
Важное условие — препарат не должен выводиться только парным органов. Иначе состояние усугубится
- Сахарный диабет с вовлечением в патологический процесс периферических сосудов (страдают конечности), также выделительной системы. Рост концентрации холестерина в связи с течением эндокринного заболевания.
- Падение сократительной функции миокарда. Хроническая сердечная недостаточность.
- Облитерирующий атеросклероз рук или ног (без отложения холестериновых бляшек).
- Нефропатия на фоне текущего сахарного диабета. Суть ее заключается в поражении почек, прогрессирующем снижении фильтрующей функции.
Указанные показания в большинстве своем предполагают комплексную терапию, одних ингибиторов АПФ недостаточно. Не считая легких и средних форм артериальной гипертензии как диагноза или симптоматического момента.
Не всегда целесообразно применять указанную фармацевтическую группу если речь идет только об атеросклерозе, гиперхолестеринемии без роста показателей тонометра. Есть более подходящие средства.
Внимание:
В любом случае, использовать лекарства нужно только по рекомендации врача. Это не безобидные витамины (кстати, и они могут негативно подействовать при неправильном использовании).
При систематическом приеме ингибиторы АПФ почти вдвое снижают вероятность инсульта или инфаркта, защищают кардиальные структуры и сосуды, почки от деструкции. Косвенным образом нормализуют сократительную способность миокарда.
БИОХИМИЯ — Л. Страйер — 1984
ГЛАВА 6. ВВЕДЕНИЕ В ЭНЗИМОЛОГИЮ
6.14. Конкурентное и неконкурентное ингибирование различаются по кинетике
Измерение скоростей катализа при разных концентрациях субстрата дает возможность отличить конкурентное ингибирование от неконкурентного. При конкурентном ингибировании на графике, где 1/Vотложена против 1/, прямая пересекает ось ординат в одной и той же точке независимо от присутствия ингибитора; меняется только угол наклона прямой (рис. 6.17). Это показывает, что при конкурентном ингибировании Vmах не изменяется. Особенность конкурентного ингибирования состоит в том, что при достаточно высокой концентрации субстрата ингибирование может быть преодолено. В самом деле, субстрат и ингибитор конкурируют за один и тот же участок. При достаточно высокой концентрации субстрата почти все активные центры заняты субстратом и фермент проявляет полную активность. Увеличение угла наклона прямой на графике зависимости 1/Vот 1/ указывает на прочность связи конкурентного ингибитора. В присутствии конкурентного ингибитора уравнение (16) заменяется следующим:
(24)
где – концентрация ингибитора, а Кi-константа диссоциации комплекса фермент -ингибитор
(25)
Другими словами, в присутствии конкурентного ингибитора наклонпрямой увеличивается на величинуРассмотрим фермент Км, равной 10-4 М. В отсутствие ингибитора V = Vmах/2 при = 10-4 М. В присутствии 2 • 10-3 М конкурентного ингибитора, связывающегося с ферментом с Ki=10-3М, кажущаяся Км составит 3 • 10-4 М. Отсюда V = Vmах/4.
Рис. 6.17. Кинетика ферментативной реакции на графике двойных обратных величин в присутствииили в отсутствие конкурентного ингибитора. Vmах не меняется, Кмвозрастает
При неконкурентном ингибировании (рис. 6.18) Vmах уменьшается, а это значит, что пересечение прямой с осью ординат произойдет в более высокой точке. В той же мере возрастает и наклон прямой, равный Kм/V1mах— в отличие от Vmax Км не изменяется при этом виде ингибирования. Повышение концентрации субстрата не снимает неконкурентного ингибирования. Максимальная скорость реакции VImax в присутствии неконкурентного ингибитора задается уравнением
(26)
Рис. 6.18. Кинетика ферментативной реакции на графике двойных обратных величин в присутствии или в отсутствие (О—О) неконкурентного ингибитора. Неконкурентный ингибитор не влияет на Км, но снижаетVmах
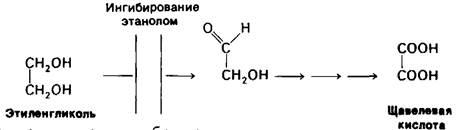
6.15. Лечение отравления этиленгликолем на основе конкурентного ингибирования
Ежегодно около 50 человек погибают от отравления этиленгликолем-добавки в антифриз для автомобильных двигателей. Сам по себе этиленгликоль не обладает летальной токсичностью. Собственно, ядом является продукт его окисления-щавелевая кислота. Первый этап превращения-окисление этиленгликоля алкогольдегидрогеназой (рис. 6.19). Эту реакцию можно эффективно затормозить путем введения большой, почти токсичной дозы этанола. Механизм действия состоит в том, что этанол оказывается конкурентным субстратом и потому блокирует окисление этиленгликоля в альдегидные производные. Этиленгликоль при этом выводится, не причиняя вреда. Такой же принцип лежит в основе лечения метанольного отравления.
Рис. 6.19. Этанол подавляет образование щавелевой кислоты из этиленгликоля
6.16. Аллостерические ферменты не подчиняются кинетике Михаэлиса-Ментен
Модель Михаэлиса-Ментен оказала большое влияние на развитие энзимологии. Достоинство этой модели — в простоте и широкой применимости. Все же не все ферменты подчиняются кинетике Михаэлиса-Ментен. В первую очередь-это большая группа аллостерических ферментов, для которых зависимость скорости реакции V от концентрации субстрата имеет сигмоидную форму, а не гиперболическую, как предсказывает уравнение Михаэлиса-Ментен . Вспомним, что кривая связывания кислорода для миоглобина-гиперболическая, тогда как для гемоглобина-сигмоидная. Ситуация с ферментами совершенно аналогична. В аллостерических ферментах один активный центр в молекуле фермента оказывает влияние на другой активный центр в той же молекуле. В результате такого взаимодействия между субъединицами связывание субстрата становится кооперативным, и кривая зависимости V от приобретает сигмоидную форму. Кроме того, активность аллостерических ферментов может регулироваться воздействием определенных молекул, связывающихся с ферментом в некаталитических участках, подобно тому, как на связывание кислорода гемоглобином влияют бисфосфоглицерат, Н+ и СO2.
ПредыдущаяСледующая