Разница между апоферментом и голоферментом
Содержание:
- Процесс синтеза ферментов
- Примечания
- Основное отличие — апофермент против голоэнзима
- Разница между коферментом и кофактором
- Биосинтез
- Биосинтез
- Физико-химические свойства
- Биосинтез
- Сиртуин 1 – мощнейший регулятор клеточного метаболизма
- Вариант 17
- Действие кофермента НАД при приеме добавок и дозировка
- Глава 10. ВИТАМИНЫ И КОФЕРМЕНТЫ
- Что такое фермент
- Способы улучшения биодоступности кофермента Q10
- Что такое кофермент
- Рефлексотерапия
- Чем опасна недостача витаминов?
Процесс синтеза ферментов
Функции ферментов определяются еще на генетическом уровне. Т. к. молекула по большому счету – белок, то и ее синтез в точности повторяет процессы транскрипции и трансляции.
Синтез ферментов происходит по следующей схеме. Вначале с ДНК считывается информация о нужном энзиме, в результате чего образуется мРНК. Матричная РНК кодирует все аминокислоты, которые входят в состав энзима. Регуляция ферментов может происходить и на уровне ДНК: если продукта катализируемой реакции достаточно, транскрипция гена прекращается и наоборот, если возникла потребность в продукте, активизируется процесс транскрипции.
После того как мРНК вышла в цитоплазму клетки, начинается следующий этап – трансляция. На рибосомах эндоплазматической сети синтезируется первичная цепочка, состоящая из аминокислот, соединенных пептидными связями. Однако молекула белка в первичной структуре еще не может выполнять свои ферментативные функции.
Активность ферментов зависит от структуры белка. На той же ЭПС происходит скручивание протеина, в результате чего образуются сначала вторичная, а потом третичная структуры. Синтез некоторых ферментов останавливается уже на этом этапе, однако для активизации каталитической активности зачастую необходимо присоединение кофермента и кофактора.
В определенных областях эндоплазматической сети происходит присоединение органических составляющих энзима: моносахаридов, нуклеиновых кислот, жиров, витаминов. Некоторые ферменты не могут работать без наличия кофермента.
Кофактор играет решающую роль в образовании четвертичной структуры белка. Некоторые функции ферментов доступны только при достижении белком доменной организации
Поэтому для них очень важно наличие четвертичной структуры, в которой соединяющим звеном между несколькими глобулами белка является ион металла
Примечания
- ↑ Березов Т. Т., Коровкин Б. Ф. Биологическая химия: учебник. — М.: Медицина, 1998. — 704 с.
- Ключников С. О., Гнетнева Е. С. Убихинон. Теория и клиническая практика // Педиатрия им. Сперанского. — 2008. — № 3. — стр 103-110
- White, J. (англ.). National Cancer Institute (14 May 2014). — «The FDA has not approved coenzyme Q10 for the treatment of cancer or any other medical condition.». Дата обращения 29 июня 2014.
- Каленикова Е. И., Городецкая Е. А., Медведев О. С. Фармакокинетика коэнзима Q10 // Бюллетень экспериментальной биологии и медицины. — 2008. — Т. 146. — № 9, стр 288
- ↑
- ↑
- ↑
- ↑
- ↑
- Кравцова Л. А., Березницкая В. В., Школьникова М. А. Применение коэнзима Q10 в кардиологической практике // Российский вестник перинатологии и педиатрии. — 2007. — Т. 52. — № 6. — С. 51-58.
- Mortensen SA, Vadhanavikit S, Folkers K. Deficiency of coenzyme Q10 in myocardial failure // Drugs under Experimental and Clinical Research. — 1984. — № 7. — Р. 497—502.
- Baggio E, Gandini R et al . Italian multicenter study on the safety and efficacy of coenzyme Q10 as adjunctive therapy in heart failure. CoQ10 Drug Surveillance Investigators // Molecular Aspects of Medicine. — 1994 — № 15. — Р. 287—294.
Основное отличие — апофермент против голоэнзима
Ферменты — это биологические катализаторы, которые катализируют биохимические реакции, происходящие внутри клетки. Фермент становится активным только тогда, когда клетке необходимо выполнить биохимическую реакцию, катализируемую этим конкретным ферментом. Апофермент и голофермент — это два состояния ферментов. главное отличие между апоферментом и голоферментом является то, что апофермент является каталитически неактивным белковым компонентом фермента, тогда как голофермент является каталитически активной формой фермента, состоящей из апофермента и кофактора. Кофактором может быть ион металла или небольшая органическая молекула. Основная функция кофактора заключается в связывании со структурой апофермента, чтобы помочь функции фермента.
Ключевые области покрыты
1. Что такое апофермент — определение, факты, деятельность2. Что такое Хофермент — определение, факты, деятельность3. Каковы сходства между апоферментом и голоферментом — Краткое описание общих черт4. В чем разница между апоферментом и голоферментом — Сравнение основных различий
Ключевые термины: апофермент, кофермент, кофактор, конъюгированный фермент, голофермент, простетическая группа
Разница между коферментом и кофактором
Определение
Коэнзим: Коэнзим — это небольшие органические небелковые молекулы, которые переносят химические группы между ферментами.
Кофактор: Кофактор представляет собой небелковое химическое соединение, которое тесно и слабо связывается с ферментом или другими белковыми молекулами.
Типы
Коэнзим: Коэнзим является разновидностью кофактора.
Кофактор: Найдено два типа кофакторов: коферменты и протезные группы.
Коэнзим: Коферменты — это молекулы.
Кофактор: Кофакторы являются химическими соединениями.
Коэнзим: Коферменты — это органические молекулы.
Кофактор: Кофакторы являются неорганическими соединениями.
переплет
Коэнзим: Коферменты слабо связаны с ферментами.
Кофактор: Кофакторы, такие как ионы металлов, ковалентно связаны с ферментом.
функция
Коэнзим: Коферменты способствуют биологическим превращениям.
Кофактор: Кофакторы помогают функции относительного фермента.
Роль
Коэнзим: Коферменты служат переносчиками ферментов.
Кофактор: Кофакторы увеличивают скорость реакции, которая катализируется соответствующим ферментом.
Удаление
коферменты: Коферменты можно легко удалить из фермента, поскольку они слабо связаны с ферментом.
Кофактор: Кофакторы могут быть удалены только путем денатурирования фермента.
Примеры
Коэнзим: Витамины, биотин, кофермент А являются коферментами.
Кофактор: Ионы металлов, такие как Zn2+К+ и Mg2+ являются кофакторами.
Заключение
Коэнзим и кофактор являются двумя типами небелковых соединений, которые помогают функционировать ферментам, которые катализируют различные биохимические реакции, происходящие в живых организмах. И коферменты, и кофакторы связываются с активным центром фермента. Существует два типа кофакторов, известных как коферменты и металлы. Коферменты — это органические молекулы, которые слабо связываются с ферментом. Металлы — это неорганические протезные группы, которые тесно связаны с ферментом. Коферменты в основном участвуют в превращении электронов, специфических атомов или функциональных групп. Однако основное различие между коферментом и кофактором заключается в их природе связывания с ферментом во время катализа биохимических реакций.
Ссылка:1. Хельменстин, к.т.н. Анна Мария. «Что такое кофермент? Определение и примеры. ”ThoughtCo. Н.п., н.д. Web. 22 мая 2017
Биосинтез
Кофермент A синтезируется в пять этапов из пантотеновой кислоты (витамина B5) и цистеина:
- Пантотеновая кислота фосфорилируется в 4′-фосфопантотенат с помощью фермента пантотенаткиназы
- Цистеин присоединяется к 4′-фосфопантотенату с помощью фермента фосфопантотеноилцистеинсинтетазы с образованием 4′-фосфо-N-пантотеноилцистеина
- 4′-фосфо-N-пантотеноилцистеин декарбоксилируется с образованием 4′-фосфопантотеина с помощью фермента фосфопантотеноилцистеиндекарбоксилазы
- 4′-фосфопантотеин с адениловой кислотой формирует дефосфо-КоA под действием фермента фосфопантотеинаденилтрансферазы
- Наконец, дефосфо-КоA фосфорилируется АТФ в кофермент A с помощью фермента дефосфокоэнзимкиназы.
Биосинтез
Кофермент A синтезируется в пять этапов из пантотеновой кислоты (витамина B5) и цистеина:
- Пантотеновая кислота фосфорилируется в 4′-фосфопантотенат с помощью фермента пантотенаткиназы
- Цистеин присоединяется к 4′-фосфопантотенату с помощью фермента фосфопантотеноилцистеинсинтетазы с образованием 4′-фосфо-N-пантотеноилцистеина
- 4′-фосфо-N-пантотеноилцистеин декарбоксилируется с образованием 4′-фосфопантотеина с помощью фермента фосфопантотеноилцистеиндекарбоксилазы
- 4′-фосфопантотеин с адениловой кислотой формирует дефосфо-КоA под действием фермента фосфопантотеинаденилтрансферазы
- Наконец, дефосфо-КоA фосфорилируется АТФ в кофермент A с помощью фермента дефосфокоэнзимкиназы.
Физико-химические свойства
По химической природе кофермент Q имеет сходство в строении молекулы с витаминами Е и К и представляет собой 2,3-диметокси-5-метил-1,4-бензохинон с изопреновой цепью в 6-м положении. Число остатков изопрена в боковой цепи убихинона в разных организмах разнится от 6 до 10. Такие варианты кофермента Q обозначают как Сo Q6, Сo Q7 и т. д.
В клетках Saccharomyces cerevisiae содержится Co Q6, Escherichia coli — Co Q8, грызунов — Co Q9. В митохондриях клеток большинства млекопитающих, включая человека, встречается убихинон только с 10 изопреновыми звеньями.
Кофермент Q представляет собой желто-оранжевые кристаллы без вкуса и запаха. Температура плавления 49—51° С. Растворим в диэтиловом эфире, очень слабо растворим в этаноле, практически нерастворим в воде. На свету постепенно разлагается и окрашивается. С водой образует эмульсию с концентрацией 10 %, 20 % и 40 %.
Биосинтез
Кофермент A синтезируется в пять этапов из пантотеновой кислоты (витамина B5) и цистеина:
- Пантотеновая кислота фосфорилируется в 4′-фосфопантотенат с помощью фермента пантотенаткиназы
- Цистеин присоединяется к 4′-фосфопантотенату с помощью фермента фосфопантотеноилцистеинсинтетазы с образованием 4′-фосфо-N-пантотеноилцистеина
- 4′-фосфо-N-пантотеноилцистеин декарбоксилируется с образованием 4′-фосфопантотеина с помощью фермента фосфопантотеноилцистеиндекарбоксилазы
- 4′-фосфопантотеин с адениловой кислотой формирует дефосфо-КоA под действием фермента фосфопантотеинаденилтрансферазы
- Наконец, дефосфо-КоA фосфорилируется АТФ в кофермент A с помощью фермента дефосфокоэнзимкиназы.
Сиртуин 1 – мощнейший регулятор клеточного метаболизма
Тему я аккуратно начал в заметке по миметики физической нагрузки. Разберу подробней SIRT1.
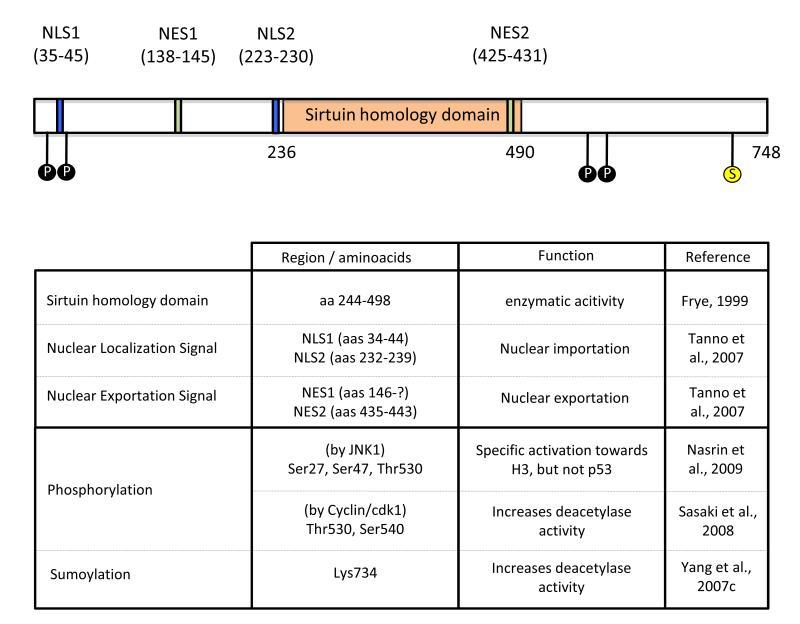
Рисунок выше, Сиртуин 1 состоит из 747 аминокислот. NLS – ядерная локализация, NES – ядерные эскпортационные сигналы, P – места фосфорилирования, S – место посттрансляционной модификации SUMO-белками.
Резюмирую выводы о структуре:
- Белок SIRT1 может проявлять себя как в ядре, так и в цитоплазме клетки;
- Каталитическая основа величиной в 240 аминокислот с N- и C-терминалами по всей поверхности говорят об значительном потенциале воздействия белка; Остальное разберем по ходу заметки.
SIRT1 – это NАD+ активируемая деацитилаза, действующая в ответ на сигнал недостатка нутриентов. SIRT1 запускает адаптации организма к голоду. Недостаток нутриентов – это несбалансированное соотношение АМФ/АТФ, что априори будет транслироваться повышенным соотношением NАD+/NADH.
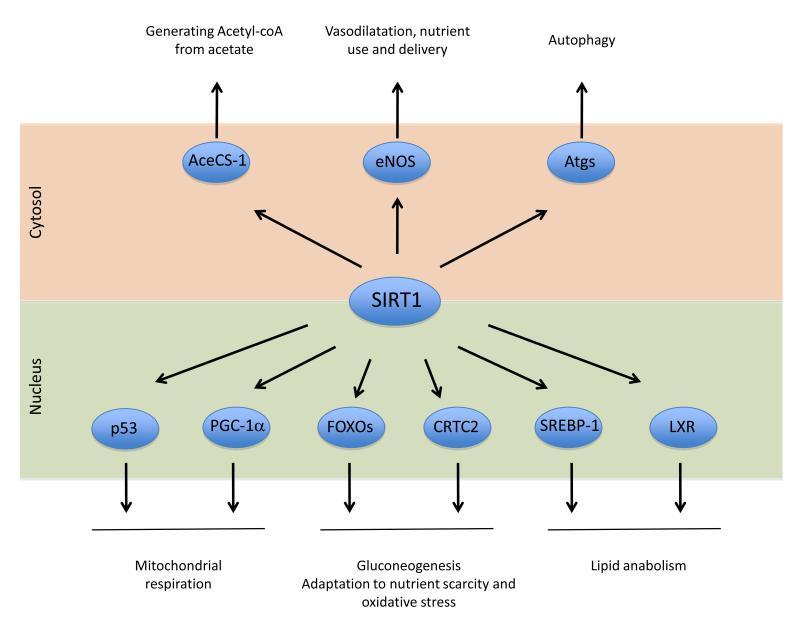
Ядерные эффекты SIRT1 (деацетилирование целевых генов приводит к изменению их выраженности):
p53 – антиопухолевый ген, который снижает смертность от рака;
PGC-1α – который запускает процессы митохондриального биогенеза, переключения с углеводов на бета-оксидацию жиров, контролирует анаболизм жира, модулирует роль инсулина и многое другое – наш кето-проводник в контексте заметки; если которого, то стимуляция кислородного дыхания (окислительного фосфорилирования).
Ключевой механизм запуска бета-оксидации и сопутствующих адаптаций к голоду является ось: повышенное соотношение NАD+/NADH > SIRT1 > PGC-1α.
FOXO гены связаны с продолжительностью жизни, их деацетилирование увеличивает продолжительность жизни за счет адаптации к недостатку нутриентов;
CRT2С2 запускает процесс глюконеогенеза; при этом важно помнить, что глюконеогенез потребляет АТФ, что не самая лучшая долгосрочная стратегия, поэтому это саморегулирующийся процесс; Известные многим адептам кето PEPCK и G6P-гены, контролирующие глюконеогенез, активируются (и саморегулируются) осью NАD+ > SIRT1 > CRTCs
Liver C Receptor (LXR) и FOXO блокируют анаболизм жира; С анаболизма на катаболизм жира нас переключает сигнал NAD+ > SIRT1 > PGC1-α > LXP > SREBP-1
Цитозольный цели SIRT1:
AceCS-1 стимулирует расщепление ацетата до ацетил Кофермента А (субстрат для цикла Кребса);
eNOS – расширения кровеносных сосудов для улучшенной доставки нутриентов; То есть дефицит нутриент способствует доставки источников энергии в ткани;
Atgs белки – участвуют в процессе аутофагии.
Пара вещей, чтобы не растягивать заметку:
- SIRT1 KO-мыши умирали после рождения;
- У людей с ожирением концентрация SIRT1 снижена;
- Посттрансляционная модификация (СУМО-илирование) SIRT1 происходит при УФ радиации или повышенной концентрации H2O2 (пероксид водорода, реактивный вид кислорода);
Промежуточный вывод: SIRT1 – ключевой регулятор клеточного метаболизма в ответ на недостаток нутриентов. Изменения белков митохондрий или внешнее воздействие активируют и деактивируют SIRT1, что значимо влияет на адаптацию организму к метаболическому стрессу.
Общие лейтмотивы: окисление жиров, биогенез митохондрий, долголетие, сниженная смертность от метаболических болезней.
Вариант 17
1. В качестве пестицидов используют:
а) ферменты
б) изоферменты
в) активаторы ферментов
г) ингибиторы ферментов
2. В роли небелковой части фермента могут выступать:
а) витамины, углеводы, минеральные вещества
б) нуклеотиды, витамины, атомы металлов
в) белки, жиры, углеводы
г) металлы, органические молекулы, ионы
3. При наличии активатора скорость ферментативной реакции:
а) уменьшается
б) увеличивается
в) не изменяется
г) увеличивается, затем остается постоянной
4. Фермент каталаза относятся к:
а) лиазам
б) изомеразам
в) оксидоредуктазам
г) трансферазам
5. Субстратом фосфолипаз является:
а) фосфат
б) крахмал
в) липиды
г) фосфолипиды
6. При уменьшении количества кислорода скорость ферментативной реакции с участием амилазы:
а) уменьшается
б) увеличивается
в) не изменяется
г) увеличивается, затем остается постоянной
7. Вещества, замедляющие ход ферментативных реакций, называются:
а) ингибиторы
б) активаторы
в) катализаторы
г) денатураторы
8. Участок молекулы фермента, к которому присоединяется вещество, способное вызвать изменение ее конфигурации, называется:
а) каталитическим центром
б) аллостерическим центром
в) простетической группой
г) активным центром
9. При увеличении количества фермента скорость ферментативной реакции
а) уменьшается
б) увеличивается
в) не изменяется
г) увеличивается, затем остается постоянной
10. Ферменты, постоянно присутствующие в живых клетках, называются:
а) индуцируемыми
б) конституционными
в) мультиферментами
г) изоферментами
Действие кофермента НАД при приеме добавок и дозировка
Молекулы , которые могут быть приняты в форме добавки для повышения уровня НАД в организме некоторые называют «ускорители НАД».
Исследования, проведенные за последние шесть десятилетий, показывают, действие кофермента НАД при приеме добавки НАД:
- Может помочь восстановить функцию митохондрий
- Помогает восстановить кровеносные сосуды. Исследование, проведенное на мышах 2018 года, показало, что добавки могут помочь в восстановлении и росте старых кровеносных сосудов. Есть также некоторые доказательства, что он может помочь управлять факторами риска сердечно-сосудистых заболеваний. Таких как высокое кровяное давление и высокий уровень холестерина.
- Может улучшить мышечную функцию. Одно исследование на животных, проведенное в 2016 году, показало, что дегенеративные мышцы улучшили свою функцию при добавлении прекурсоров НАД+.
- Потенциально помогает ремонтным клеткам и поврежденной ДНК. Некоторые исследования показали, что добавление предшественника НАД+ приводит к увеличению восстановления поврежденной ДНК. НАД+ расщепляется на две составляющие: никотинамид и АДФ-рибозу, которые в сочетании с белками восстанавливают клетки.
- Может помочь улучшить когнитивные функции. Несколько исследований, проведенных на мышах, показали — у мышей, получавших предшественники НАД+, наблюдалось улучшение когнитивных функций, обучения и памяти. Полученные данные привели исследователей к убеждению, что добавка НАД может помочь защитить от снижения когнитивных функций/болезни Альцгеймера.
- Может помочь предотвратить увеличение веса, связанное с возрастом. Проведено исследование в 2012 году на мышах. Когда мыши, получавшие пищу с высоким содержанием жиров, давали добавки НАД, они набирали на 60% меньше веса. Это в сравнении с тем же питании без добавок. Одна из причин заключается в том, что никотинамид-адениндинуклеотид помогает регулировать выработку гормонов, связанных со стрессом и аппетитом. Это благодаря его влиянию на циркадные ритмы.
Предшественники — это молекулы, используемые в химических реакциях внутри организма для создания других соединений. Есть ряд предшественников НАД+, которые приводят к более высоким уровням, когда мы потребляете их в достаточном количестве.
Эти предшественники включают аминокислоты и витамин В3. Некоторые из наиболее важных предшественников для повышения уровня НАД — это различные формы витамина B3. Особенно NR, который, по мнению некоторых экспертов, является наиболее эффективным предшественником НАД+.
Одно исследование показало, что одна однократная доза NR может увеличить уровень НАД+ у людей в 2,7 раза. Другие формы витамина В3, которые, по-видимому, менее эффективны для повышения уровня, включают никотиновую кислоту и никотинамид.
Типы и рекомендации по дозировке:
Предшественник никотинамид рибозид (NR), также называемый ниагеном, доступен в форме таблеток или капсул. Типичная доза добавок NR составляет от 200 до 350 миллиграммов, принимаемых один или два раза в день.
В исследованиях было показано, что дозы 100, 300 и 1000 мг NR ежедневно оказывают положительное воздействие и вызывают дозозависимое повышение уровня НАД+ в крови.
Иногда врачи назначают более высокие дозы терапии НАД для пациентов в виде внутримышечных (ВМ) или внутривенных (IV) инъекций НАД. Этот тип лечения может использоваться, например, для лечения симптомов болезни Паркинсона, деменции или депрессии.
В случае, если Вы решили принимать добавки кофермента НАД рекомендуем рассмотреть следующие варианты:
- Now Foods, NADH, 10 мг, 60 капсул на растительной основе
- Source Naturals, ENADA NADH, 5 мг, 30 таблеток
- Source Naturals, NADH, 20 mg, 30 таблеток
Глава 10. ВИТАМИНЫ И КОФЕРМЕНТЫ
Витамины и коферменты, скорее всего, не только можно, но и необходимо рассматривать вместе, в одном разделе химии природных соединений, поскольку нельзя провести четкого разграничения определенной группы природных биологически активных веществ на два таких класса. С другой стороны, при освещении химии этих соединений мы неизбежно коснемся вопросов строения и свойств их, а отсюда неизбежен и выход на реакции, катализируемые ферментами (коферментами). Таким образом, эти три феномена химии живой природы — витамины, коферменты и ферментативный катализ не то чтобы тесно связаны, они завязаны в один узел, и комплексное их описание вполне уместно.
Но в любом случае, какая-то, хоть и ограниченная, классификация является полезной, поэтому в понятия “витамины” и “коферменты” можно проставить следующие акценты и ввести некоторые определения. Витаминами можно назвать некую группу низкомолекулярных органических соединений различной химической природы, необходимых для осуществления жизненно важных биохимических процессов in vivo Природные соединения, не являющиеся витаминами, но легко превращающиеся в них в организме человека, называются провитаминами. Если несколько соединений близкой химической природы выполняют одну и ту же витаминную функцию в организме — их называют витамерами.
Теперь дадим определение коферментам. Коферменты — это органические природные низкомолекулярные соединения различной химической природы, необходимые для осуществления каталитического действия ферментов, катализирующих химические процессы in vivo. В чем же различие? Скорее всего в том, что понятие витамины — более общее, а во-вторых, коферменты являются, как правило, производными витаминов.
В связи с тем, что уже сказано о витаминах и коферментах, можно провести следующее их разграничение: а) собственно витамины — это соединения, выполняющие свою витаминную роль самостоятельно, б) витамины-коферменты — соединения, выполняющие определенную биохимическую функцию в виде производных, т.е. в виде коферментов, в) следует выделить отдельно группу коферментов, т.е. тех соединений, которые образованы из соответствующих витаминов или синтезированы самостоятельно данным организмом для осуществления того или иного химического процесса в живой клетке. В свою очередь, кофермент выполняет свою каталитическую функцию либо в свободной форме, т.е. самостоятельно, либо в ферментносвязанном виде, о чем более подробно будет сказано позже.
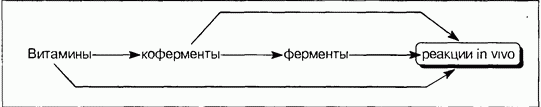
Теперь можно представить взаимосвязь между всеми соединениями и явлениями этого раздела природной химии следующей простой схемой:
Что такое фермент
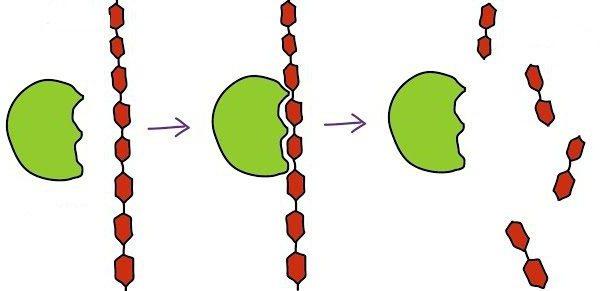
Фермент — это биологическая макромолекула, состоящая из белков. Основная функция фермента — катализировать специфическую биохимическую реакцию внутри клетки при температуре тела и рН. Следовательно, ферменты являются биологическими катализаторами, от которых зависят все биологические системы. Таким образом, ферменты играют решающую роль в поддержании жизни.

Рисунок 1: Действие фермента
Большинство ферментов представляют собой глобулярные белки с высоким молекулярным весом. Их способность катализировать определенную биохимическую реакцию является одной из характерных особенностей фермента. Более того, они активны при определенной температуре и рН. Они также требуют связывания кофактора с активным сайтом, чтобы активировать апофермент к голоферменту, активной форме фермента. Некоторые неорганические кофакторы включают Mg2+Fe2+, Zn2+и Mn2+ в то время как небольшие органические молекулы, которые действуют как кофакторы, называются коферментами
Важно отметить, что для катализа требуется только небольшое количество фермента. Действие фермента в основном регулируется аллостерическими механизмами, при которых продукт, образуемый ферментом, ингибирует фермент, ингибируя образование большего количества продуктов
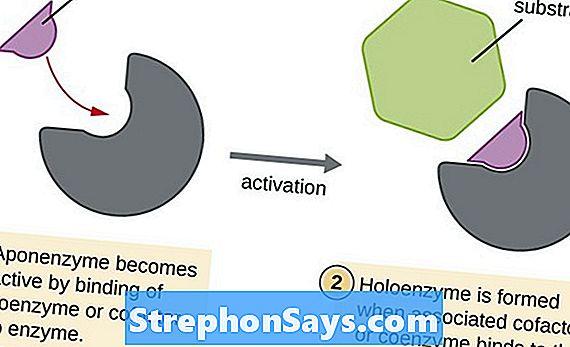
Рисунок 2: Действие кофактора
Есть шесть типов ферментов, основанных на типе реакции, которую они катализируют. Это оксидоредуктазы, трансферазы, лиазы, гидролазы, лигазы и изомеразы. Помимо действия внутри организма, ферменты используются в пищевой промышленности для ферментации, а также в медицине для ускорения заживления ран, уничтожения патогенных микроорганизмов, диагностики заболеваний и т. Д.
Способы улучшения биодоступности кофермента Q10
Кофермент Q10 является жирорастворимым соединением с большим размером молекулы. Усвоение кофермента Q10 организмом происходит так же, как и всех жирорастворимых веществ. Его всасывание, как и всех жирорастворимых веществ, происходит в тонком кишечнике с обязательным этапом предварительного эмульгирования желчью и образованием мицелл. В составе мицелл он проникает в клетки кишечника. Эффективность всасывания зависит от:
- Степени эмульгирования желчью кофермента Q10;
- Размеров образующихся после эмульгирования мицелл (не более 0,5 мкм);
- Площади поверхности активного всасывания в кишечнике;
- Присутствия других жиров в пище.
Производители[какие?] прибегают к использованию различных способ для улучшения биодоступности в выпускаемых препаратах кофермента Q10.
Уменьшение размеров частиц
Очевидным путём повышения биодоступности является уменьшение частиц кофермента Q10 до микро- и наноразмеров. На примере многих лекарственных веществ было показано, что уменьшение размеров частиц приводит к изменению биодоступности и эффективности. Однако в целом, применительно к коферменту Q10, уменьшение размеров частиц не приводит к большому успеху в повышении биодоступности.
Заключение в капсулы с маслом
Хорошо известен тот факт, что всасывание жирорастворимых веществ улучшается, если в пище присутствуют липиды. Поэтому некоторые производители[какие?] для повышения биодоступности кофермента Q10 в препарате заключают его в капсулы с маслом.
Повышение растворимости в воде
Повышение биодоступности лекарственных веществ путём улучшения его растворимости в воде является часто используемым и применим также и к коферменту Q10. Примером такого подхода является получение водно-масляной микроэмульсии. Жирорастворимая форма Q10 с помощью пищевого эмульгатора переводится в водорастворимую форму, при этом образуются микроэмульсия, состоящая из водной фазы и ассоциатов Q10-эмульгатор. Технология молекулярного капсулирования позволяет переводить жирорастворимые вещества в водорастворимую форму; избежать в процессе всасывания этапа эмульгирования желчью жирорастворимого вещества; уменьшить размер частиц жирорастворимого вещества до всасываемых размеров. Это обеспечивает максимальное усваивание препарата, увеличивает биодоступность по сравнению с жирорастворимой формой Q10 в 2,6 раза и делает препарат более эффективным.
Что такое кофермент
Коэнзим — это небольшая органическая молекула, которая действует как кофактор. Он связывается с ферментами, помогая функции фермента. Способствуя ферментативному действию, коэнзимы служат промежуточными носителями электронов, определенных атомов или функциональных групп между биохимическими реакциями. Некоторые из функциональных групп, переносимых коферментами, представляют собой гидрид-ионы, атомы водорода, метильные группы и ацильные группы. При связывании с химической группой структура кофермента изменяется. Следовательно, коферменты можно рассматривать как второй субстрат для фермента. Следовательно, они называются субстратами. Коэнзимы необходимо регенерировать, чтобы участвовать в реакции снова и снова.

Рисунок 3: Вовлечение коферментов в цикл лимонной кислоты
Некоторые коферменты включают NAD (никотин-адениндинуклеотид), NADP (никотин-адениндинуклеотид-фосфат), FAD (флавин-адениндинуклеотид) (Vit.B2), CoA (коэнзим A), CoQ (коэнзим Q), тиамин (витамин B1), пиридоксин ( витамин В6), биотин, фолиевая кислота и др.
Рефлексотерапия
- Руководство по рефлексотерапии
- Медицинская акупунктура
- Рефлексотерапия в комплексном лечении нервной системы
- Рефлексотерапия в комплексном лечении болезней пародонта
- Мануальная гомеопатическая и рефлексотерапия остеохондроза позвоночника
- Иглорефлексотерапия
-
Фитотерапия
-
Фитотерапия в комплексном лечении заболеваний внутренних органов
- Краткая история фитотерапии
- Теоретические обоснования фитотерапии
-
Химический состав, классификация и биологически активные группы растений
- Углеводы
- Лекарственные растения и сырье, содержащие полисахариды и другие углеводы
- Гликозиды
- Растения и сырье, содержащие флавоноиды, их основное биологическое действие
- Растения и сырье, содержащие антрагликозиды слабительного действия
- Дубильные вещества
- Эфирные масла
- Органические кислоты
- Алкалоиды
- Витамины и коферменты
- Ферменты
- Макро- и микроэлементы
- Способы использования лекарственных растений
- Фитотерапия при заболевании органов дыхания
- Фитотерапия в лечении сердечно-сосудистых заболеваний
- Фитотерапия в лечении заболеваний органов пищеварения
- Заболевания почек и мочевых путей
- Эндокринные заболевание и целебные свойства трав
- Ревматические заболевания
- Фитотерапия при аллергии
- Геморрагии и тромбозы
- Лекарственные средства в народной медицине
- Лекарственные растения в дерматологии и косметологии
- Фитотерапия в стоматологии
-
Фитотерапия в комплексном лечении заболеваний внутренних органов
- Гомеопатия
- Атлас клинической аурикулотерапии
Чем опасна недостача витаминов?
Молекулы ферментов (в том числе энзимов) работают очень быстро и слаженно: они проделывают порядка миллиона операций за одну секунду. После той или иной реакции может появиться токсичная перекись водорода, однако фермент, точнее, его молекулы, расщепляет перекись на воду и кислород. Клетки состоят из множества ферментов, которые участвуют в различных реакциях. направлены на поддержание здоровья каждой клетки. Фермент имеет основу, в качестве которой выступает белковая молекула, для того чтобы она начала работать, нужны такие специальные коферменты, как коэнзимы. Если человек употребляет в пищу продукты, в которых нет витаминов, кофермент образуется не в полной мере, а без него не может активизироваться тот или иной фермент. В результате скорость биохимической реакции, за которую отвечает конкретный фермент, снижается. Далее происходит нарушение обменных процессов в организме. Коферментная функция витаминов нужна для улучшения обменных процессов внутри клетки.
В такую систему развития патологических состояний укладывается не каждый авитаминоз. Есть отдельная группа витаминов, которая на сегодняшний день не входит ни в одну коферментную группу, это витамины С и Р. Таким образом, суждения об авитаминозах как о коферментах являются не едиными, допустимо существование иных способов развития патологических процессов. Если данные представления правдивы и обоснованны, в будущем будет установлена коферментная функция всех без исключения витаминов. На сегодняшний день существуют коферменты, не имеющие предшественников, это карнитин, фосфаден и липоевая кислота. Принято считать, что витамины не могут синтезироваться в организме, они должны поступать только с пищей. Данные вещества играют особую роль в процессе обмена веществ. Стоит помнить, что они должны поступать в малом количестве: для полноценной жизнедеятельности человеку требуется всего несколько миллиграммов в сутки.
Антивитамины и поливитамины: основные функции
Данные компоненты делятся по признаку растворимости, они могут быть жирорастворимые (A, D, E, K), а также водорастворимые (C и витамины группы B). Первые копятся в организме, причем их депо являются жировая ткань и печень. Вторые в значительных количествах не депонируются, а при избыточном содержании выводятся вместе водой, в связи с этим они должны поступать регулярно. В результате недостачи витаминов может возникнуть множество опасных заболеваний, например, рахит. Во избежание этого недуга следует употреблять достаточное количество белков, углеводов, жиров и других полезных компонентов.
Первые элементы, которые носят название «витамины», были открыты сто лет назад. Сам термин появился на свет в 1912 году, его решил предложить польский ученый Каземир Функ. Латинское слово «vita» означает «жизнь», «amin» — соединение с азотом. Помимо витаминов существуют также антивитамины и поливитамины. Первые представляют собой органические соединения, при помощи которых происходит подавление витаминов. Данные компоненты имеют очень схожий состав с самими витаминами, однако они дают противоположный эффект.
https://youtube.com/watch?v=YSCf5AQJH0I
Если в организм попадают антивитамины, они замещают полезные вещества и вместо них включаются в обменную реакцию. В результате происходит витаминная недостаточность, причем даже тогда, когда в организм попадает достаточное количество питательных веществ. Антивитамин есть почти для каждого витамина, данный компонент может участвовать в развитии заболеваний. Поливитамины представлены в виде специальных препаратов, которые имеют в своем составе витамины и минеральные вещества. Природным поливитамином является грудное молоко, в котором содержится множество полезных компонентов. Лекарства с витаминами часто используются для профилактики гиповитаминоза, а также для лечения некоторых желудочных заболеваний. Препараты, содержащие витамины, могут быть назначены маленьким детям: у них организм отличается большей чувствительностью, восприимчивостью к заболеваниям.