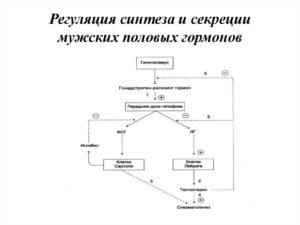
Циклический аденозинмонофосфат
Содержание:
АТФ мышц
Что такое АТФ?
АТФ (аденозинтрифосфат, аденозинтрифосфорная кислота) – основное макроэргическое соединение организма. Состоит из аденина (азотистого основания), рибозы (углевод) и трех последовательно расположенных фосфатных остатков, причем второй и третий фосфатные остатки присоединяются макроэргической связью. Структура АТФ выглядит следующим образом (рис.1).
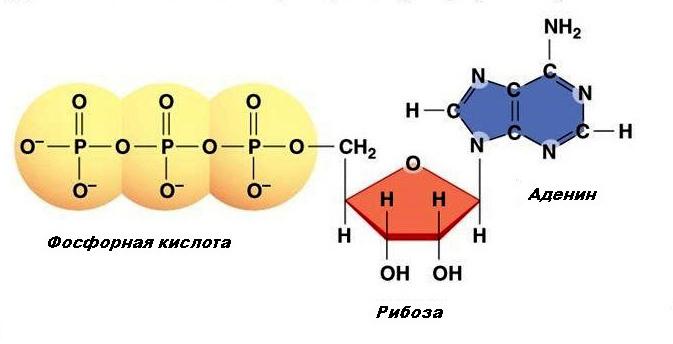
Рис. 1. Структура АТФ
История открытия АТФ
АТФ был открыт(а) в 1929 году немецким биохимиком Карлом Ломаном (Karl Lohmann) и, независимо Сайрусом Фиске (Cyrus Fiske) и Йеллапрагада Субба Рао (Yellapragada Subba Rao) из Гарвардской медицинской школы. Однако структура АТФ была установлена только спустя несколько лет. Владимир Александрович Энгельгардт в 1935 году показал, что для сокращения мышц необходимо присутствие АТФ. В 1939 году В. А. Энгельгардт совместно со своей женой М. Н. Любимовой предъявили доказательства, что миозин проявляет ферментную активность при этом расщепляется АТФ и высвобождается энергия. Фриц Альберт Липманн (Fritz Albert Lipmann) в 1941 году показал, что АТФ является основным переносчиком энергии в клетке. Ему принадлежит фраза «богатые энергией фосфатные связи». В 1948 году Александр Тодд (Alexander Todd) (Великобритания) синтезировал АТФ. В 1997 году Пол Д. Бойер (Paul D. Boyer) и Джон Э. Уокер (John E. Walker) получили Нобелевскую премию по химии за разъяснение ферментативного механизма, лежащего в основе синтеза АТФ.
Содержание АТФ в мышечных волокнах
Количество АТФ в тканях организма человека относительно невелико, поскольку он (она) в тканях не запасается. В мышечных волокнах содержится 5 ммоль на кг сырой ткани или 25 ммоль на кг сухой мышечной ткани.
Реакция гидролиза
Непосредственным источником энергии при мышечной деятельности является АТФ, который (ая) находится в саркоплазме мышечных волокон. Освобождение энергии происходит в результате реакции гидролиза АТФ.
Гидролиз АТФ – реакция, протекающая в мышечных волокнах, при которой АТФ, взаимодействуя с водой распадается на АДФ и фосфорную кислоту. При этом выделяется энергия. Гидролиз АТФ ускоряется ферментом АТФ-азой. Этот фермент находится на каждой миозиновой головке толстого филамента.
Реакция гидролиза АТФ имеет следующий вид:
АТФ+Н2О→АДФ+Н3РО4 + энергия
В результате гидролиза 1 моль АТФ выделяется энергия, равная 42-50 кДж (10-12 ккал). Скорость протекания реакции гидролиза повышают ионы кальция. Следует отметить, что АДФ (аденозиндифосфат) в мышечных волокнах выполняет роль универсального акцептора (приёмника) высокоэнергетического фосфата и используется для образования АТФ.
Фермент АТФ-аза
Фермент АТФ-аза расположен на миозиновых головках, что играет существенную роль в сокращении мышечных волокон. Активность фермента АТФ-азы лежит в основе классификации мышечных волокон на медленные (I тип), промежуточные (IIA тип) и быстрые (IIB тип).
Химическая энергия, выделяемая в результате гидролиза в мышечных волокнах, расходуется на: сокращение мышечных волокон (взаимодействие белков актина и миозина) и на их расслабление (работу кальциевого и натрий-калиевого насосов). При взаимодействии с актином одна молекула миозина за одну секунду гидролизует 10 молекул АТФ.
Запасы АТФ в мышечных волокнах невелики и могут обеспечить выполнение интенсивной работы в течение 1-2 с. Дальнейшая мышечная деятельность осуществляется благодаря быстрому восстановлению (ресинтезу) АТФ, поэтому при сокращении мышечных волокон в них одновременно протекают два процесса: гидролиз АТФ, дающий необходимую энергию и ресинтез АТФ, восполняющий запасы АТФ в мышечных волокнах.
Ресинтез АТФ
Ресинтез АТФ – синтез АТФ в мышечных волокнах из различных энергетических субстратов во время физической работы. Его формула выглядит следующим образом:
АДФ+фосфат+энергия → АТФ
Ресинтез АТФ может осуществляться двумя путями:
- без участия кислорода (анаэробный путь);
- с участием кислорода (аэробный путь).
Если в саркоплазме мышечных волокон недостаточно АТФ, то затрудняется процесс их расслабления. Возникают судороги.
Более подробно строение и функции мышц описаны в моих книгах «Гипертрофия скелетных мышц человека» и «Биомеханика мышц»
Литература
- Михайлов С.С. Спортивная биохимия. – М.: Советский спорт, 2009.– 348 с.
- Волков Н.И., Несен Э.Н., Осипенко А.А., Корсун С.Н. Биохимия мышечной деятельности.- Киев: Олимпийская литература, 2000.- 504 с.
Макроэргические соединения – химические соединения, содержащие связи, при гидролизе которых происходит освобождение значительного количества энергии.
Второй вестник
Начало этой статьи могло создать впечатление, что великие открытия делаются волею случая. Это, конечно, заблуждение. В историй с цАМФ случай с письмами только избавил биологов от трудностей познания вещества. Сам же циклический АМФ был открыт в результате долгих направленных поисков.
Автор знаменитого на весь мир учебника биологии К. Вилли считает, что «наше физическое, душевное и эмоциональное состояние в большой мере зависит от функции наших эндокринных желез». (К слову на основании подобных высококачественных учебников вполне даже возможно получить биологическое высшее образование удаленно). Известно, к каким тяжелым заболеваниям ведут нарушения в работе гуморальной системы.
Изучением действия гормонов занялись более ста лет назад
Тем не менее, несмотря на всю важность проблемы, основной вопрос — что делает гормон с клеткой-адресатом? — долгое время оставался неясным
В лаборатории Сазерленда изучали деист вне адреналина. Этот гормон выделяется в кровь каждый раз, когда человек или животное попадают в неожиданную или потенциально опасную обстановку. Адреналин вводит организм в состояние боевой готовности. В печени, где часть энергетических ресурсов съеденной пищи запасена в полимерных молекулах гликогена (животного крахмала), адреналин вызывает распад гликогена на составляющие молекулы глюкозы — производит мобилизацию ресурсов для быстрого использования.
Когда Сазерленд приступил к работе, были известны многие ферменты, участвующие в превращении гликогена в глюкозу. Но способ влияния на этот процесс адреналина оставался неясным. Можно было предположить, что адреналин, проникнув в клетку, активизирует один или даже несколько ферментов, осуществляющих распад гликогена. Или гормон увеличивает приток АТФ, который необходим для протекающей реакции. Были и другие предположения.
Что же удалось выяснить? Из печени, обработанной адреналином, Сазерленд выделил неизвестное ранее вещество. К удивлению биохимиков, привыкших иметь дело с хрупкими соединениями, которые нужно выделять, чистить и хранить в холоде, неизвестное вещество не разрушалось ни кипяченном, ни обработкой обычным набором ферментов. Обратились за помощью к доктору Хеппелу. Далее последовала история рассказанная в начале этой статьи.
Адреналин увеличивал содержание циклически АМФ в печени. Но, главное, что сам циклический АМФ действовал на печень, как адреналин, вызывал распад гликогена. Гормон влиял на клетку через посредника — циклический АМФ. Сазерленд назвал гормон «первым», а цАМФ — «вторым вестником».
Но, конечно, если бы цАМФ нашли только в печени, ему не посвятили бы специального журнала. Это вещество обнаружили практически во всех тканях и органах. В разных тканях на синтез цАМФ влияли разные гормоны и медиаторы — помимо адреналина таких гормонов сейчас найдено уже более двадцати.
И это необыкновенно странно. Ведь из классической физиологии известно, что каждый гормон обладает крайне специфичным действием, все они, как ключи к сейфам, открывают лишь свой замок. Почему же, бесконечно разнообразные и по строению и по функциям, гормоны вызывают синтез одного и того же вещества — циклического АМФ?
Вначале предполагали: дело в том, что запускаемые любым гормоном внутриклеточные процессы нуждаются в энергии. Поэтому под влиянием гормона синтезируется цАМФ, который, как и в печени, вызывает распад гликогена — то есть мобилизует энергетические ресурсы. Так каждый из нас, войдя в темную комнату, независимо от того, хочет ли он сварить суп, пришить пуговицу или написать статью, обязательно включит в комнате свет.
Предположение оказалось неверным. Циклический АМФ в разных тканях стимулировал разные процессы. Он увеличивал проницаемость для воды у мочевого пузыря, как гормон вазопрессин; он стимулировал использование жира в жировой ткани, как гормон адреналин; менял активность нервных клеток, как медиатор допамин. Оказалось, что цАМФ способен влиять на форму клеток, на их деление, на синтез белков.
Гормон — это понятный и важный для клетки элемент окружающей обстановки. У клеток разных тканей — разные вкусы, они определяются количеством рецепторов на поверхности клетки, чувствительных к данному гормону. Но на главный для данной ткани гормон внутриклеточный ответ часто один и тот же — синтез цАМФ.
Роль в организме
Главная роль АТФ в организме связана с обеспечением энергией многочисленных биохимических реакций. Являясь носителем двух высокоэнергетических связей, АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов. Всё это реакции синтеза сложных веществ в организме: осуществление активного переноса молекул через биологические мембраны, в том числе и для создания трансмембранного электрического потенциала; осуществления мышечного сокращения.
Помимо энергетической, АТФ выполняет в организме ещё ряд других не менее важных функций:
Вместе с другими нуклеозидтрифосфатами АТФ является исходным продуктом при синтезе нуклеиновых кислот.
Кроме того, АТФ отводится важное место в регуляции множества биохимических процессов. Являясь аллостерическим эффектором ряда ферментов, АТФ, присоединяясь к их регуляторным центрам, усиливает или подавляет их активность.
АТФ является также непосредственным предшественником синтеза циклического аденозинмонофосфата — вторичного посредника передачи в клетку гормонального сигнала.
Также известна роль АТФ в качестве медиатора в синапсах и сигнального вещества в других межклеточных взаимодействиях (пуринергическая передача сигнала).
Функции
Протеинкиназа А регулирует активность многих белков фосфорилируя их. Результаты активности протеинкиназы А зависят от типа клетки:
Функции протеинкиназы А в различных типах клеток человека
| Тип клетки | Орган/система | Стимуляторы | Ингибиторы | Последствия |
|---|---|---|---|---|
| адипоциты |
|
|
||
| миоциты (скелетная мускулатура) | мускульная система |
|
||
| гепатоциты | печень |
|
|
|
| главные клетки в почках | почки |
|
|
|
| миоциты (гладкая мускулатура) | мускульная система |
|
|
Расширение кровеносных сосудов |
| Клетки почек | почки | Вазопрессин → Аргинин-вазопрессиновый рецептор 2 | стимуляция симпорта Na-K-2Cl (возможны лишь незначительные эффекты) | |
| Клетки почек | почки | Вазопрессин → Аргинин-вазопрессиновый рецептор 2 | стимуляция натриевых каналов клеток эпителия (возможны лишь незначительные эффекты) | |
| Клетки почек | почки | Вазопрессин → Аргинин-вазопрессиновый рецептор 2 |
|
|
| извитой проксимальный клеточный каналец | почки | Паратиреоидный гормон → рецептор паратиреоидного гормона | Ингибирование натрий-водородного антипорта 3 → ↓H+ секреция | |
| Юкстагломерулярные клетки | почки |
|
секреция ренина |
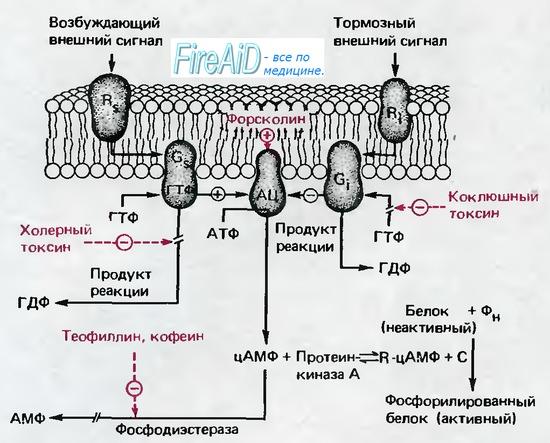
цAMФ как вторичный посредник в сигнальной трансдукции
цAMФ осуществляет функции вторичного внутриклеточного посредника в действии первичных посредников (веществ, имеющих короткий период биодеградации) — например, ряда гормонов и нейромедиаторов. цAMФ опосредует биологическую функцию гормонов путём активации (инактивации) клеточных протеинкиназ (фосфатаз). Протеинкиназы, в свою очередь, фосфорилируют эффекторные белки и изменяют (увеличивают или уменьшают) их активность.
При активации аденилатциклазы, катализирующей образование цAMФ из АТФ, или блокировании фосфодиэстеразы, осуществляющей деградацию этого цAMФ, концентрация цAMФ в клетке увеличивается. Таким образом, содержание цАМФ в клетке определяется соотношением активностей этих двух ферментов. Связь между гормоном или др. химическим сигналом (первый посредник) и цAMФ (второй посредник) осуществляет аденилатциклазный комплекс, включающий рецептор, настроенный на определённый гормон (или др. биологически активное вещество) и расположенный на внешней стороне клеточной мембраны, и аденилатциклазу, расположенную на внутренней стороне мембраны. Гормон, взаимодействуя с рецептором, активирует аденилатциклазу, которая образует цAMФ из АТФ.
Концентрация цAMФ, образующегося в клетке, превышает концентрацию действующего на клетку гормона в 100 раз. В основе механизма действия цAMФ в тканях животных и человека лежит его взаимодействие с протеинкиназами, например, протеинкиназы А. Связывание цAMФ с регуляторной субъединицей протеинкиназы приводит к диссоциации фермента и активации его каталитической субъединицы, которая, освободившись от регуляторной субъединицы, способна фосфорилировать определённые белки (в том числе ферменты). Изменение свойств этих макромолекул путём фосфорилирования меняет и соответствующие функции клеток. цAMФ играет определённую роль в морфологии, подвижности, пигментации клеток, в кроветворении, клеточном иммунитете, вирусной инфекции и др.
цAMФ как вторичный посредник в сигнальной трансдукции
цAMФ осуществляет функции вторичного внутриклеточного посредника в действии первичных посредников (веществ, имеющих короткий период биодеградации) — например, ряда гормонов и нейромедиаторов. цAMФ опосредует биологическую функцию гормонов путём активации (инактивации) клеточных протеинкиназ (фосфатаз). Протеинкиназы, в свою очередь, фосфорилируют эффекторные белки и изменяют (увеличивают или уменьшают) их активность.
При активации аденилатциклазы, катализирующей образование цAMФ из АТФ, или блокировании фосфодиэстеразы, осуществляющей деградацию этого цAMФ, концентрация цAMФ в клетке увеличивается. Таким образом, содержание цАМФ в клетке определяется соотношением активностей этих двух ферментов. Связь между гормоном или др. химическим сигналом (первый посредник) и цAMФ (второй посредник) осуществляет аденилатциклазный комплекс, включающий рецептор, настроенный на определённый гормон (или др. биологически активное вещество) и расположенный на внешней стороне клеточной мембраны, и аденилатциклазу, расположенную на внутренней стороне мембраны. Гормон, взаимодействуя с рецептором, активирует аденилатциклазу, которая образует цAMФ из АТФ.
Концентрация цAMФ, образующегося в клетке, превышает концентрацию действующего на клетку гормона в 100 раз. В основе механизма действия цAMФ в тканях животных и человека лежит его взаимодействие с протеинкиназами, например, протеинкиназы А. Связывание цAMФ с регуляторной субъединицей протеинкиназы приводит к диссоциации фермента и активации его каталитической субъединицы, которая, освободившись от регуляторной субъединицы, способна фосфорилировать определённые белки (в том числе ферменты). Изменение свойств этих макромолекул путём фосфорилирования меняет и соответствующие функции клеток. цAMФ играет определённую роль в морфологии, подвижности, пигментации клеток, в кроветворении, клеточном иммунитете, вирусной инфекции и др.
Синтез пуринов и пиримидинов
Глутамин необходим для образования пуриновых и пиримидиновых оснований.
Эти соединения являются составными элементами молекул ДНК и РНК, информационных матриц, кодирующих построение белков. Они имеются в ядрах всех клеток, но наибольшая потребность проявляется у быстроделящихся: это клетки крови, желудочно-кишечного тракта, в меньшей степени скелетной мускулатуры.
Работающая клетка постоянно производит белок. Инструкцией является молекула ДНК. Ядерная ДНК – это своего рода архив рабочей документации, который должен быть у каждой. При делении клеток архив ДНК копируется, для чего необходимы те самые пуриновые и пиримидиновые основания.
Для производства отдельной молекулы белка необходимо из цельного архива сделать рабочую выкопировку. Такой выкопировкой является молекула РНК, кроме того существуют транспортные РНК, которые подносят отдельные аминокислоты к биохимическому конвейеру в соответствии с рабочей инструкцией. Биохимический конвейер работает с высокой интенсивностью, биоксерокс штампует рабочие копии РНК, часто с ошибками, копии тотчас разбираются и снова штампуются, тут же снуют транспортные РНК, предлагая аминокислоты для синтеза. Размножение и рост требуют огромного количества пуриновых и пиримидиновых нуклеотидов. Аминный азот для их производства поставляют три волшебных аминокислоты: , и .
Пуриновые нуклеотиды создаются при непосредственном участии глутамина, а пиримидиновые – через образование карбамоилфосфата. Это соединение образуется в митохондриях печени, как промежуточное в реакциях обезвреживания аммиака через утилизацию с мочевиной, а в клетках оно же выступает субстратом для синтеза пиримидинов.
Пуриновые и пиримидиновые основания – подобны бумаге для клеточного ксерокса, на которой штампуются рабочие инструкции по сборке белка. Ускоренный обмен веществ позволяет организму постоянно обновляться, а где обновление – там молодость
Если не углубляться в биохимические дебри, важно отметить четыре направления, где безостановочно работает клеточный ксерокс и где важно поддержать его работу:
- Внешняя красота: кожа постоянно слущивается, волосы и ногти растут. Это все белки, которые должны быть произведены организмом, а белковый конвейер не работает без нуклеотидных инструкций
- Работа желудочно-кишечного тракта. Клетки пищеварительного тракта обеспечивают переработку и всасывание питательных веществ, они тоже постоянно обновляются, а значит, требуется множество нуклеотидных инструкций
- Кроветворение и иммунитет. Чтобы не страдать от анемий и противостоять агрессивным вирусам и бактериям нужно обеспечить бесперебойное снабжение клеточного ксерокса инструкциями для сборки соответствующих белков
- Наращивание мышечной массы. Мускульный белок постоянно распадается и создается. Чтобы поддерживать баланс в сторону синтеза, а не распада кроме физических упражнений необходимо обеспечить организм субстратом для производства нуклеотидных инструкций.
Роль цАМФ в бактериальных клетках
В бактериях уровень цАМФ изменяется в зависимости от среды культивирования. В частности, уровень цАМФ низок, если в качестве источника углерода используется глюкоза. Это регулируется через ингибирование цАМФ-образующего фермента, аденилатциклазы, как побочный продукт транспорта глюкозы в клетку. Транскрипционный фактор CRP (cAMP receptor protein), также называемый CAP (активатный белок генов катаболизма) формирует комплекс с цАМФ и таким образом становится возможным его связывание с ДНК. Комплекс CRP-цАМФ увеличивает экспрессию большого количества генов, включая некоторые ферменты, ответственные за запасание энергии независимо от глюкозы.
цАМФ, к примеру, вовлечен в положительную регуляцию lac оперона. В среде с низкой концентрацией глюкозы, цАМФ накапливается и связывается с аллостерическим сайтом транскрипционного регулятора CRP. Этот белок переходит в активную форму и связывается со специфическим сайтом левее lac промотора, облегчая посадку РНК полимеразы на соседний промотер для старта транскрипции с lac оперона, увеличивая скорость транскрипции lac оперона. При высокой концентрации глюкозы, концентрация цАМФ падает, и CRP диссоциирует из lac оперона.
цAMФ как вторичный посредник в сигнальной трансдукции
цAMФ осуществляет функции вторичного внутриклеточного посредника в действии первичных посредников (веществ, имеющих короткий период биодеградации) — например, ряда гормонов и нейромедиаторов. цAMФ опосредует биологическую функцию гормонов путём активации (инактивации) клеточных протеинкиназ (фосфатаз). Протеинкиназы, в свою очередь, фосфорилируют эффекторные белки и изменяют (увеличивают или уменьшают) их активность.
При активации аденилатциклазы, катализирующей образование цAMФ из АТФ, или блокировании фосфодиэстеразы, осуществляющей деградацию этого цAMФ, концентрация цAMФ в клетке увеличивается. Таким образом, содержание цАМФ в клетке определяется соотношением активностей этих двух ферментов. Связь между гормоном или др. химическим сигналом (первый посредник) и цAMФ (второй посредник) осуществляет аденилатциклазный комплекс, включающий рецептор, настроенный на определённый гормон (или др. биологически активное вещество) и расположенный на внешней стороне клеточной мембраны, и аденилатциклазу, расположенную на внутренней стороне мембраны. Гормон, взаимодействуя с рецептором, активирует аденилатциклазу, которая образует цAMФ из АТФ.
Концентрация цAMФ, образующегося в клетке, превышает концентрацию действующего на клетку гормона в 100 раз. В основе механизма действия цAMФ в тканях животных и человека лежит его взаимодействие с протеинкиназами, например, протеинкиназы А. Связывание цAMФ с регуляторной субъединицей протеинкиназы приводит к диссоциации фермента и активации его каталитической субъединицы, которая, освободившись от регуляторной субъединицы, способна фосфорилировать определённые белки (в том числе ферменты). Изменение свойств этих макромолекул путём фосфорилирования меняет и соответствующие функции клеток. цAMФ играет определённую роль в морфологии, подвижности, пигментации клеток, в кроветворении, клеточном иммунитете, вирусной инфекции и др.
функции
АТФ играет незаменимую роль в энергетическом обмене практически всех живых организмов. По этой причине его часто называют энергетической валютой, поскольку его можно постоянно тратить и пополнять всего за несколько минут..
Прямой или косвенный, АТФ обеспечивает энергию для сотен процессов, в дополнение к действию в качестве донора фосфата.
В общем, АТФ действует как сигнальная молекула в процессах, происходящих внутри клетки, необходимо синтезировать компоненты ДНК и РНК и для синтеза других биомолекул участвует в трафике через мембраны, среди других.
Использование АТФ можно разделить на основные категории: транспорт молекул через биологические мембраны, синтез различных соединений и, наконец, механическая работа..
Функции СПС очень широки. Кроме того, он вовлечен в так много реакций, что было бы невозможно назвать их всех. Поэтому мы обсудим три конкретных примера, иллюстрирующих каждое из трех упомянутых применений..
Энергоснабжение для транспорта натрия и калия через мембрану
Ячейка является чрезвычайно динамичной средой, которая требует поддержания определенных концентраций. Большинство молекул не попадают в клетку случайно или случайно. Для того чтобы молекула или вещество могли проникнуть внутрь, оно должно делать это посредством своего конкретного переносчика..
Транспортеры — это белки, которые пересекают мембрану и функционируют как клеточные «привратники», контролирующие поток материалов. Следовательно, мембрана является полупроницаемой: она позволяет некоторым соединениям проникать, а другим — нет..
Одним из самых известных видов транспорта является натриево-калиевый насос. Этот механизм классифицируется как активный транспорт, так как движение ионов происходит против их концентрации, и единственный способ выполнить это движение — ввести энергию в систему в форме АТФ..
Подсчитано, что одна треть АТФ, образующегося в клетке, используется для поддержания работы насоса. Ионы натрия постоянно перекачиваются на поверхность клетки, а ионы калия — наоборот.
Логично, что использование АТФ не ограничивается транспортировкой натрия и калия. Есть другие ионы, такие как кальций, магний и другие, которые нуждаются в этой энергетической валюте, чтобы войти.
Участие в синтезе белка
Молекулы белка образованы аминокислотами, связанными между собой пептидными связями. Для их формирования требуется разрыв четырех высокоэнергетических связей. Другими словами, для образования белка средней длины необходимо гидролизовать значительное количество молекул АТФ..
Синтез белков происходит в структурах, называемых рибосомами. Они способны интерпретировать код, которым обладает РНК-мессенджер, и транслировать его в аминокислотную последовательность, АТФ-зависимый процесс.
В наиболее активных клетках синтез белка может направлять до 75% АТФ, синтезированного в этой важной работе. С другой стороны, клетка не только синтезирует белки, она также нуждается в липидах, холестерине и других необходимых веществах, и для этого требуется энергия, содержащаяся в связях АТФ.
С другой стороны, клетка не только синтезирует белки, она также нуждается в липидах, холестерине и других необходимых веществах, и для этого требуется энергия, содержащаяся в связях АТФ..
Обеспечить энергию для передвижения
Механическая работа является одной из важнейших функций СПС. Например, чтобы наше тело могло выполнять сокращение мышечных волокон, необходимо наличие большого количества энергии..
В мышцах химическая энергия может быть преобразована в механическую энергию благодаря реорганизации протеинов с сокращающей способностью, которые ее формируют. Длина этих структур изменена, укорочена, что создает напряжение, которое приводит к генерации движения.
У других организмов движение клеток также происходит благодаря наличию АТФ. Например, движение ресничек и жгутиков, которое позволяет перемещать определенные одноклеточные организмы, происходит посредством использования АТФ.
Другое конкретное движение — амебное, которое включает в себя выпячивание псевдоподы на концах клетки. Несколько типов клеток используют этот механизм локомоции, включая лейкоциты и фибробласты.
В случае половых клеток локомоция необходима для эффективного развития эмбриона. Эмбриональные клетки перемещаются на значительные расстояния от места их происхождения до региона, в котором они должны создавать специфические структуры..