Окислительно восстановительные реакции
Содержание:
- Техническая подготовка работников
- Виды окислительно-восстановительных реакций
- Технология
- Редокс-потенциал
- Восстановление в органической химии
- Восстановление срока для подачи апелляционной жалобы по гражданскому делу
- Восстановление срока для подачи жалобы по делу об административном правонарушении
- Восстановление в органической химии
- Шаги
- Реакции восстановления в биоорганической химии
- Электролиз , как окислительно-восстановительный процесс
- Что такое окисление и восстановление и их связь с периодическим законом Д. И. Менделеева
Техническая подготовка работников
С целью совершенствования профессиональных знаний и практических навыков работников в каждом восстановительном поезде организуется техническая подготовка по ведению аварийно-восстановительных работ, которая включает в себя теоретические и практические занятия, а также полигонные учения.
Теоретические занятия проводятся по разработанным программам еженедельно в техническом классе (специально оборудованном помещении восстановительного поезда).
Технический класс имеет плакаты, стенды, макеты, учебные пособия, инструктивные карты, техническую литературу, видео- и компьютерную технику с обучающими программами, нормативную и техническую литературу, а также учебную доску, столы и стулья.
Практические занятия проводятся не реже одного раза в месяц либо на учебно-тренировочном полигоне, либо (при значительном удалении полигона от места постоянной дислокации восстановительного поезда) на специально подготовленных учебных местах на территории восстановительного поезда.
Учебно-тренировочный полигон оборудуется, как правило, на небольшом удалении от места постоянной дислокации восстановительного поезда. Полигон имеет не менее двух железнодорожных путей, на одном из которых оборудуется участок контактной сети, а также площадку с комплектом калиброванных грузов для проведения практических занятий по подъёму и перемещению грузов и для проведения статических и динамических испытаний кранов.
Для отработки работниками восстановительного поезда необходимых навыков по подъёму (уборке) подвижного состава и испытания приспособлений для ведения аварийно-восстановительных работ полигон оснащается непригодными для использования в перевозочной деятельности по сроку службы и техническому состоянию вагонами разного типа (пассажирскими и грузовыми крытыми вагонами, полувагонами, хоппер-дозаторами, четырёх- и восьмиосными цистернами), а также локомотивами серий, работающих на участке обслуживания восстановительного поезда.
Вагоны и локомотивы, передаваемые на учебно-тренировочный полигон, списанию не подлежат.
На полигоне имеются также грунтовая площадка и дорога со специально оборудованными препятствиями (ров, холм, брод) для совершенствования навыков в управлении автомобилями и тяговыми машинами, в том числе с использованием установленного на них бульдозерного (бульдозерно-рыхлительного) оборудования и тяговых лебёдок.
На каждой железной дороге создаётся не менее одного восстановительного поезда (базового), в котором наряду с решением задач по штатному предназначению проводится стажировка вновь назначенных руководителей восстановительных поездов и обмен передовым опытом по ликвидации последствий сходов с рельсов подвижного состава.
Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных
веществ, например:
-
- H2S+Cl2→S+2HCl{\displaystyle {\mathsf {H_{2}S+Cl_{2}\rightarrow S+2HCl}}}
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
-
- 2H2O→2H2+O2{\displaystyle {\mathsf {2H_{2}O\rightarrow 2H_{2}+O_{2}}}}
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
-
- H2O+Cl2→HCl+HOCl{\displaystyle {\mathsf {H_{2}O+Cl_{2}\rightarrow HCl+HOCl}}}
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления:
-
- SO2+2H2S→3S+2H2O{\displaystyle {\mathsf {SO_{2}+2H_{2}S\rightarrow 3S+2H_{2}O}}}
Технология
Процессы получения губчатого железа осуществляются при умеренных температурах с использованием газообразного или твердого восстановителя в различных агрегатах: шахтных, трубчатых, туннельных, муфельных, отражательных, электронагревательных печах, ретортах периодического действия, конвейерных машинах, реакторах с кипящим слоем и др. Иногда эти агрегаты соединены в комплексы, в которых наиболее часто сочетаются с электропечью (электродоменной или дуговой) для получения жидкого металла (чугуна и стали). Чаще всего губчатое железо применяют как высокочистую добавку к стальному лому. Наиболее стабильный спрос на губчатое железо отмечается в странах с недостаточными мощностями доменного производства и поставками стального лома.
Основными процессами, используемыми на работающих, строящихся и проектных установках для производства губчатого железа, являются процессы с применением шахтных печей и реторт периодического действия. Процессы с использованием вращающихся печей и твердого восстановителя находят промышленное применение, главным образом, при переработке металлургических отходов — пылей и шламов, которые содержат примеси цинка, свинца и др., а также комплексных железных руд (богатых титаном, хромом, никелем, марганцем и др.), не пригодных для использования в доменных печах. Процессы в кипящем слое получили меньшее распространение в связи с целым рядом специфических особенностей (жесткие требования к гранулометрическому составу, газодинамические ограничения существования кипящего слоя, температурные условия и др.).
Процессы металлизации в шахтных печах во многом похожи на процессы, протекающие в шахте доменных печей в области умеренных температур. Однако имеются и значительные отличия: в шахтной печи отсутствует кокс; важную роль в процессах восстановления оксидов железа играет водород; восстановительный газ является единственным источником тепла, обеспечивающим все тепловые потребности процесса.
В процессе восстановления окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии газа (твердого топлива), которые содержат водород. Водород легко восстанавливает железо:
- Fe2O3+3H2 →1000∘C 2Fe+3H2O{\displaystyle {\mathsf {Fe_{2}O_{3}+3H_{2}\ {\xrightarrow {1000^{\circ }C}}\ 2Fe+3H_{2}O}}},
при этом не происходит загрязнения железа такими примесями как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде и в дальнейшем переплавляется в электрических печах. Для получения тонны железа прямым восстановлением из руды необходимо затратить примерно 1000 м3 водорода.
По своей сути процесс прямого восстановления железа является восстановлением железа из руд, минуя доменный процесс, то есть кокс в процессе не участвует.
Наиболее отработанным и широко распространенным процессом является процесс Midrex. С 1983 г. на Оскольском электрометаллургическом комбинате работают четыре модуля процесса металлизации Midrex общей мощностью 1700 тыс. т металлизованных окатышей в год. В состав каждого модуля входят: шахтная печь металлизации, реформер (реактор конверсии природного газа); система производства инертного газа; система аспирации. Система водного хозяйства, свеча, помещение пульта управления и электроснабжение являются общими для каждой пары модулей.
Шахтная печь для металлизации состоит из загрузочного (промежуточного) бункера; верхнего динамического затвора с загрузочным распределителем и загрузочными трубами; зоны восстановления; промежуточной зоны; зоны охлаждения; огнеупорной футеровки; постоянно действующих питателей; нижнего динамического затвора и маятникового питателя (для выгрузки готового продукта).
Редокс-потенциал
Основная статья Редокс-потенциал
В биохимии для обозначения передаваемого от донора к акцептору одного электронного эквивалента (электрона, либо электрона и протона и др.) часто используют термин восстановительный эквивалент. Этот термин ничего не говорит о том, что именно передается — электрон как таковой, водородный атом, гидрид-ион (Н-) или же передача происходит в реакции с кислородом, приводящей к образованию окисленного продукта.
Способность восстановителя отдавать электроны окислителю выражается величиной окислительно-восстановительного потенциала (стандартного восстановительного потенциала), или редокс — потенциала.
Редокс — потенциал определяют измерением электродвижущей силы (э. д. с.) в вольтах, возникающей в полуэлементе, в котором восстановитель и окислитель, присутствующие в концентрациях равных 1 моль/литр при 25оС и рН 7,0 находятся в равновесии с электродом, способным принимать электроны от восстановителя и передавать их окислителю.
В качестве стандарта принят редокс-потенциал реакции
Н2 2Н+ + 2е, который при давлении газообразного водорода в 1 атмосферу при концентрации ионов Н+ равной 1 моль/литр (что соответствует рН=0) и при 25оС условно принят за нуль. В условиях значения рН, принятого в качестве стандарта при биохимических расчетах, то есть при рН 7,0 , редокс-потенциал (Ео´) водородного электрода (системы Н2 — 2Н+) равен — 0,42 В.
Приводим значения редокс-потенциала (Ео´) для некоторых окислительно-восстановительных пар, играющих важную роль при переносе электронов в биологических системах:
| Восстановитель | Окислитель | Ео´, В |
|---|---|---|
| Н2 | 2Н+ | — 0,42 |
| НАД • Н + Н+ | НАД+ | — 0,32 |
| НАДФ • Н + Н+ | НАДФ+ | — 0,32 |
| Флавопротеин (восстановл.) | Флавопротеин (окисл.) | — 0,12 |
| Кофермент Q • Н2 | Кофермент Q | + 0,04 |
| Цитохром B (Fe2+) | Цитохром B (Fe3+) | + 0,07 |
| ЦитохромC1 (Fe2+) | ЦитохромC1 (Fe3+) | + 0,23 |
| ЦитохромA (Fe2+) | Цитохром A(Fe3+) | + 0,29 |
| ЦитохромA3 (Fe2+) | Цитохром A3 (Fe3+) | +0,55 |
| H2O | ½ О2 | + 0,82 |
Система с более отрицательным редокс-потенциалом обладает большей способностью отдавать электроны системе с более положительным редокс-потенциалом. Например, пара НАД • Н / НАД+ , редокс-потенциал которой равен — 0,32 В будет отдавать свои электроны окислительно-восстановительной паре флавопротеин (восстановл.) / флавопротеин (окислен.), имеющей потенциал −0,12 В, то есть более положительный. Большая положительная величина редокс-потенциала окислительно-восстановительной пары вода/кислород (+0,82 В) указывает на то, что у этой пары способность отдавать электроны (то есть способность образовывать молекулярный кислород) выражена очень слабо. Иначе можно сказать, что у молекулярного кислорода очень велико сродство к электронам или водородным атомам.
Восстановление в органической химии
Первыми известными восстановителями в органической химии, использование которых началось с 1840-х годов, являются цинк, железо и сероводород. Развитие данной области органических реакций началось с двумя важными открытиями: в 1897 году было предложено каталитическое гидрирование, а в 1947 году — восстановление гидридами металлов. Каждая из этих реакций занимает примерно четверть из всех методов восстановления, а на остальную половину приходятся электрохимическое восстановление, восстановление металлами, солями металлов, органическими и неорганическими веществами.
Восстановление срока для подачи апелляционной жалобы по гражданскому делу
Для подачи апелляционной жалобы на решение по гражданскому делу у Вас есть 1 месяц со дня изготовления решения суда в мотивировочной части.
Подать жалобу в настоящее время непосредственно в суд не представляется возможным, так Президиумом Верховного суда РФ и Президиумом Совета судей РФ 18 марта и 8 апреля 2020 года были приняты совместные постановления, содержащие рекомендации о порядке работы судов.
Приостановлен личный прием граждан в судах, рекомендовано подавать процессуальные документы посредством почтовой связи и в электронном виде, с обеспечением своевременных приема, обработки и регистрации поступающих документов, рассматривать дела безотлагательного характера, дела в порядке приказного и упрощенного производства, дела, всеми участниками которых заявлены ходатайства о рассмотрении дела в их отсутствие, если их личное участие в судебном заседании не является обязательным.
Также невозможно и вовремя получить решение суда, что является препятствием для грамотного и мотивированного составления жалобы, а потому и для подачи апелляционной жалобы, в связи с чем срок бывает пропущен.
А потому при подаче апелляционной жалобы одновременно подаётся, лучше на отдельном листе, Заявление о восстановлении срока апелляционной жалобы, которое адресуется суду первой инстанции.
Заявление о восстановлении пропущенного процессуального срока рассматривается в отдельном судебном заседании суда первой инстанции, лица, участвующие в деле, извещаются о времени и месте судебного заседания, однако их неявка не является препятствием к разрешению поставленного перед судом вопроса.
Если суд срок восстановит, то он выносит определение суда об этом.
Замечание: лучше подать апелляционную жалобу краткую до истечения срока апелляционного обжалования, чтобы срок не пропустить, а потом дополнительную направить.
Восстановление срока для подачи жалобы по делу об административном правонарушении
Вынесено постановление должностным лицом, например, заместителем начальника Управления рассмотрения дел и обращений МАДИ по г. Москве, и вы подвергнуты административному наказанию в виде штрафа.
Согласно ч. 1 и 2 ст. 30.3 КоАП РФ, жалоба на постановление по делу об административном правонарушении может быть подана в течение 10 суток со дня вручения или получения копии постановления. В случае пропуска указанного срока он может быть восстановлен по ходатайству лица, подающего жалобу.
В условиях карантина, ограничительных мер по передвижению, работе судов, о привлечении вас к административной ответственности вы узнали по истечении 10 дней.
Восстановление срока обжалования постановления производится в целях всестороннего, полного, объективного и своевременного выяснения обстоятельств дела при условии, что причины пропуска обусловлены уважительными причинами.
То есть при подаче жалобы одновременно этому же суду вы пишете на отдельном листе ходатайство с просьбой восстановить срок на обжалование постановления по делу об административном правонарушении или прямо в самой жалобе указываете на это.
Суд, принимая во внимание осуществление принципа доступа граждан и юридических лиц к правосудию, гарантированного ст. 46 Конституцией Российской Федерации, а также обязанность органов публичной власти обеспечивать гражданам, юридическим лицам условия для реализации их прав и свобод, в том числе, и права на судебную защиту, придёт к выводу, что срок для подачи жалобы в суд пропущен по уважительной причине, и восстановит его
Формулировка просительной части:
прошу:
восстановить срок на обжалование постановления №0356043010518101500009825 от 15.03.2020 года, по делу об административном правонарушении, предусмотренном ст. … КоАП, в отношении фио.. ООО.., признав его пропуск уважительным.
Указанное ходатайство будет рассматриваться судом одновременно с рассмотрением самой жалобы.

Восстановление в органической химии
Первыми известными восстановителями в органической химии, использование которых началось с 1840-х годов, являются цинк, железо и сероводород. Развитие данной области органических реакций началось с двумя важными открытиями: в 1897 году было предложено каталитическое гидрирование, а в 1947 году — восстановление гидридами металлов. Каждая из этих реакций занимает примерно четверть из всех методов восстановления, а на остальную половину приходятся электрохимическое восстановление, восстановление металлами, солями металлов, органическими и неорганическими веществами.
Шаги
Метод 1 из 4:
Загрузка в безопасном режиме
-
1
Используйте безопасный режим. Загрузка в безопасном режиме – первый способ восстановить систему, работающую со сбоями. Этот режим можно использовать для борьбы с определенными типами вирусов, а также как инструмент диагностики, если вы не знаете причин нестабильной работы компьютера. Если компьютер загружается в безопасном режиме, то проблема заключается в программном обеспечении, драйверах или других файлах.
X
Источник информации -
2
Перезагрузка в безопасном режиме. Перезагрузитесь в безопасном режиме непосредственно из системы, если такая функция доступна.
-
3
Нажмите F8. Если такая функция недоступна, перезагрузите компьютер и несколько раз нажмите клавишу F8 во время загрузки. Это откроет меню загрузки.
-
4
Выберите «Безопасный режим».
-
5
Восстановление системы. Когда система загрузится в безопасном режиме, вы можете приступить к ее восстановлению. Есть целый ряд различных методов, применение которых во многом зависит от имеющейся проблемы.
- Удалите файлы, поврежденные вирусом (или такие, которые он сделал недоступными).
- Скачайте или запустите антивирусное программное обеспечение. В этом случае может потребоваться загрузка в безопасном режиме с загрузкой сетевых драйверов.
- Удалите недавно установленные программы, которые могут быть причиной проблемы.
- Обновите драйверы, если вы думаете, что устаревшие драйверы могут быть причиной проблемы.
- Сделайте восстановление системы. Для этого нажмите пуск и введите в строку поиска «Восстановление системы».
Метод 2 из 4:
Загрузка последней удачной конфигурации
-
1
Загрузка последней удачной конфигурации. Это правильный метод, если вы думаете, что неподходящий драйвер или неправильно установленные обновления системы являются причиной проблемы. С помощью этого метода также можно избавиться от определенных типов вирусов.
X
Источник информации -
2
Отключите все носители информации. Отключите (вытащите) все CD-диски, DVD-диски, USB накопители.
-
3
Перезапустите систему.
-
4
Нажмите несколько раз клавишу F8 при загрузке системы.
-
5
Выберите «Загрузка последней удачной конфигурации».
-
6
Нажмите Enter.
-
7
Дождитесь загрузки системы. Это может занять несколько минут — больше, чем обычно, так как система будет восстанавливаться.
Метод 3 из 4:
Переустановка системы
-
1
Если это возможно, сделайте резервную копию наиболее важных данных. Если вы не можете исправить систему никаким другим способом, то следующий метод будет заключаться в форматировании диска и переустановке системы. Поэтому сделайте резервную копию наиболее важных данных.
-
2
Найдите установочный диск. Возьмите установочный диск Windows.
-
3
Откройте привод дисков.
-
4
Вставьте установочный диск Windows.
-
5
Перезагрузите компьютер.
-
6
Нажмите любую клавишу. Во время перезагрузки появится сообщение «Press Any Key to Boot from CD» (Нажмите любую клавишу для загрузки с компакт-диска). Нажмите любую клавишу для продолжения.
-
7
Следуйте инструкциям на экране.
Метод 4 из 4:
Полное и необратимое удаление данных
-
1
Сделайте резервную копию наиболее важных данных. Все данные будут стерты, поэтому сделайте резервную копию наиболее важных данных.
-
2
Найдите установочный диск. Вам понадобится установочный диск Windows или альтернативной ОС (например, Linux, которая является бесплатной системой), так как операционная система также будет уничтожена.
-
3
Скачайте утилиту Darik’s Boot and Nuke (DBAN). Она предназначена для полного и необратимого удаления данных с носителей информации. Есть и другие похожие программы, например Active@KillDisk. Скачайте программу с надежного веб-сайта.
X
Источник информации -
4
Запишите программу на компакт-диск или USB накопитель.
-
5
Выключите компьютер.
-
6
Вставьте диск или USB накопитель с записанной программой. -
7
Загрузите компьютер с диска или USB. Это должно происходить автоматически. Если это не так, измените порядок загрузки. Включите компьютер и во время его загрузки нажимайте клавишу F10, F11 или F12 (или другую, в зависимости от вашего компьютера), чтобы получить доступ к меню Boot. Там выберите соответствующий компакт-диск или USB накопитель.
-
8
Введите «dodshort». После того, как компьютер загрузился с компакт-диска или USB накопителя, самым быстрым способом удалить данные будет ввод команды «dodshort». Вы также можете открыть интерактивный режим, если хотите посмотреть больше опций.
-
9
Нажмите Enter.
-
10
Переустановите операционную систему. После удаления данных переустановите операционную систему и восстановите файлы из резервной копии.
Реакции восстановления в биоорганической химии
В биоорганической химии большое значение имеют реакции восстановления, которые являются составной частью различных биохимических процессов в биологических системах, а в промышленности используются для синтеза ценных биоорганических соединений.
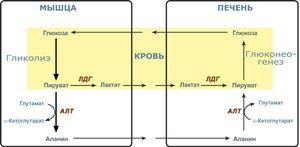
В биологических системах роль донора водорода играют различные коферменты, например НАДН, НАДФН и ФАДН2.
В организме часто протекают реакции восстановления различных азотсодержащих соединений, например нитрилов и амидов карбоновых кислот, в результате которых образуются первичные амины:
R-CN + 2*H2 → R-CH2-NH2 нитрил амин R-C(=O)-NH2 + 2*H2 → R-CH2-NH2 + H2O амид амин
В некоторых ярко окрашенных пищевых продуктах могут быть красители на основе анилина. Постоянное употребление в пищу таких продуктов может привести к серьезным последствиям, поскольку анилин проявляет высокую биохимическую активность; вступая в реакции он образует в организме человека различные токсичные соединения. Промышленное производство анилина из нитробензола является типичной реакцией восстановления (более известное как реакция Зинина):
C6H5-NO2 + H2,Ni → C6H5-NH2 нитробензол анилин
Одним из участников ферментативных процессов восстановления есть производное 1,4—дигидропиридина—НАДН, что в при восстановлении образует НАД + в различных окислительно-восстановительных реакциях в составе таких сложных циклов как цикл Кребса, цикл Кальвина и др. Например, при участии НАДН протекает in vivo реакция превращения альдегидов в спирты:
НАДН + Н+ + R-C(=O)-H → R-CH2-OH + НАД+
Вообще восстановление карбонильных соединений (альдегидов, кетонов, сложных эфиров) приводит к образованию соответствующих спиртов:
R-C(=O)-H + → R-CH2-OH альдегид первичный спирт R-C(=O)-R^ + → R-CH(OH)-R^ кетон вторичный спирт R-C(=O)-O-R^ + → R-CH2-OH + R^OH сложный эстер первичный спирт
Видное место в биоорганической химии занимает восстановление моносахаридов (альдоз, кетоз). При восстановлении альдоз получается лишь один полиол, кетоз — смесь двух полиолов. Например, при восстановлении D-фруктозы борогидридом натрия (NaBH4{\displaystyle {\ce {NaBH4}}}) образуются D-глюцита (сорбит) и D-маннит.
Важна реакция восстановительного аминирования, которая протекает в организме в процессе биосинтеза α-аминокислот. Процесс протекает по схеме присоединения-отщепления и заключается в получении α-аминокислот из альдегидов и кетонов с образованием промежуточного продукта — имина, который затем восстанавливается до амина.
Электролиз , как окислительно-восстановительный процесс
Окислительно-восстановительные реакции могут происходить и при участии электрического тока. Например, если расплавить поваренную соль, то происходит расщепление кристаллической решетки на ионы: 2NaCl ⇄ Na+ + Cl- При этом образуются катион натрия и анион хлора. Если затем опустить в расплав электроды постоянного электрического тока, происходит следующее. Направляясь к катоду, катион натрия получает с него один электрон, т. е. происходит восстановление: Na+ + e—→Na
Следовательно, катод, на котором имеется постоянный избыток электронов, является восстановителем. К аноду направляется анион хлора. Поскольку на аноде постоянный недостаток электронов, атом хлора отдает электрон, т. е. окисляется: Сl— — е— → Сl Таким образом, а н о д, на котором постоянный недостаток электронов, является окислителем. Итак, всякий электролиз есть окислительно-восстановительный процесс, протекающий под действием электрического тока. (Запишите) В связи с тем что при электролизе в реакции принимает участие электрический ток, окислительно-восстановительный процесс приобретает ряд особенностей. Например, при электролизе водных растворов солей в процессе принимает участие вода. Так, электролиз раствора поваренной соли протекает по несколько иной схеме, нежели электролиз расплава. В растворе, помимо диссоциации, соли, протекает весьма слабо диссоциация воды: Н2O ⇄ Н+ + OH— Таким образом, в растворе образуется два вида катионов (Na+ и Н+) и два вида анионов (Сl— и ОН—). В ряду напряжений металлов натрий стоит намного левее водорода. Следовательно, он активнее, а значит, и легче отдает электроны. Если же речь идет (как в данном случае) о принятии электронов на катоде, то ион натрия, наоборот, будет труднее принимать электроны, чем ион водорода, и, следовательно, на катоде будет восстанавливаться не металлический натрий, а водород: Н+ + е— → Н (0) Ионы же натрия будут находиться в растворе до тех пор, пока полностью не разрядятся ионы водорода. К аноду направятся анионы Сl— и ОН—. Эти анионы также неодинаковы. Анион Сl— легче отдает свой электрон, чем анион ОН-, поэтому на аноде будет окисляться хлор, превращаясь в нейтральные атомы хлора: Сl— — е— → Сl В большинстве случаев анионы, состоящие из атомов одного элемента, такие, как Сl—, Вr—, I—, S2- и т. п., окисляются на аноде быстрее, чем гидроксильная группа.
Таким образом, при электролизе раствора поваренной соли на электродах получаются водород и хлор, а в растворе остаются ионы Na+ и ОН—. Эти ионы представляют собой в диссоциированном виде едкий натр NaOH.
■ 142. Почему при электролизе расплава NaCl можно получить металлический натрий, а при электролизе раствора NaCl era получить нельзя? 143. Чем объяснить, что в растворе при электролизе NaCl образуется щелочь NaOH? 144. Как осуществляется электролиз раствора KI? 145. В чем отличие процесса электролиза раствора СuСl2 от электролиза раствор а NaCl? (См. Ответ)
Способ наращивания металла на поверхности изделия электролитическим путем позволяет снимать точнейшие слепки и копии. Этот способ называется гальванопластикой.
Статья на тему Окислительно восстановительные реакции
Что такое окисление и восстановление и их связь с периодическим законом Д. И. Менделеева
Все химические реакции, встречающиеся в неорганической химии, можно разделить на два типа:
1) Реакции, протекающие без изменения валентности реагирующих элементов. Сюда относятся реакции, подчиняющиеся правилу: реакции между ионами в растворах электролитов идут практически до конца в сторону образования газов, осадков, слабых электролитов или комплексных соединений (ионов).
Например:
2.Pb•• + 2NO‘3 + 2K• + SO4 = ↓ PbSO4 + 2K• + 2NO‘3
3.2K• + 2oh‘ + 2H• + SO4 = 2н2о+ 2K• + SO4
4. Fe•• + 2CN‘ + 4K• + 4CN‘ = [Fe(CN)6]»» + 4K• = K4[Fe(CN)6].
Рис. Прибор для осуществления реакции между цинком и свинцовой солью на расстоянии.