Над и надф
Содержание:
Механизм
Схема пути Энтнера — Дудорова
| Внешние изображения |
|---|
Структура 6-фосфоглюконатдегидрогеназы
Общая схема пути Энтнера — Дудорова такова. Глюкозо-6-фосфат, образовавшийся при фосфорилировании 1 молекулы глюкозы с затратой 1 молекулы АТФ, переходит в 6-фосфоглюконат с восстановлением молекулы НАДФ и образованием НАДФ٠Н. При дальнейшей дегидратации 6-фосфоглюконата образуется 2-кето-3-дезокси-6-фосфоглюконат (КДФГ) — ключевое соединение пути. КДФГ расщепляется на пируват и глицеральдегид-3-фосфат (3-ФГА). При дальнейшем окислении 3-ФГА до пирувата восстанавливается 1 молекула НАД до НАДН и образуется 2 АТФ путём субстратного фосфорилирования. В пути Энтнера — Дудорова задействованы 2 уникальных фермента: , превращающая 6-фосфоглюконат в КДФГ, и КДФГ-альдолаза, катализирующая КДФГ на пируват и 3-ФГА.
Путь Энтнера — Дудорова можно рассматривать как альтернативу гликолизу. Общая схема двух этих путей окисления глюкозы чрезвычайно похожа: 6-углеродные сахара активируются фосфорилированием и после этого разлагаются ферментами группы альдолаз на два трёхуглеродных соединения. Различие заключается в природе промежуточных 6-углеродных соединений, которые разлагаются на трёхуглеродные продукты. При гликолизе фруктозо-1,6-бифосфат разлагается на 3-ФГА и дигидроксиацетонфосфат, а при пути Энтнера — Дудорова КДФГ расщепляется на 3-ФГА и пируват. Таким образом, путь Энтнера — Дудорова содержит только две реакции, дополнительные к реакциям гликолиза и пентозофосфатного пути. Однако путь Энтнера — Дудорова отличается от гликолиза тем, что в нём образуется одна молекула НАДФ٠Н и в качестве суммарного энергетического выхода всего лишь одна, а не две, молекулы АТФ.
Реакции пентозофосфатного пути
Общая реакция пентозофосфатного пути выглядит так:
3 глюкозо-6-фосфат + 6 НАДФ + + 3 H 2 O → 6 НАДФH (H +) + 3 CO 2 + 2 фруктозо-6-фосфат + глицеральдегидфосфат;
Пентозофосфатный путь разделяют на две стадии:
- Оксинювальна, в ходе которой глюкозо-6-фосфат дегидрогенизуеться и декарбоксилируется с образованием НАДФH и рибулозо-5-фосфата, изомеризуется к рибозо-5-фосфата;
- Неокислительный, в реакциях которой рибулозо-5-фосфат превращается в промежуточных продуктов гликолиза.
Некоторые авторы выделяют в пентозофосфатному пути три этапа разделяя неокислительный стадию на две:
- Реакции изомеризации и епимеризации, в которых рибулозо-5-фосфат превращается в рибозо-5-фосфат и ксилулозо-5-фсофат;
- Серия реакций расщепления и образования CC связей, в результате которых два молекулы ксилулозо-5-фосфата и молекула рибозо-5-фосфата превращаются в двух молекул фруктозо-6-фосфата и одной молекулы глицеральдегид-3-фосфата.
Все реакции неокислительный стадии обратимы, поэтому общий выход пентозофосфатного пути очень отличается в зависимости от потребностей клетки. Например, когда есть необходимость в большом количестве рибозо-5-фосфата, стадия 3 действует в обратном порядке, то есть производит это вещество с фруктозо-6-фосфата и глицеральдегид-3-фосфата.
Окислительные реакции пентозофосфтаного пути
Первая реакция пентозофосфтаного пути — окисления глюкозо-6-фосфата в внутримолекулярного эфира 6-фосфоглюконо-δ-лактона, что происходит в результате переноса гидрид иона на НАДФ +. Катализирует этот процесс фермент глюкозо-6-фосфатдегидрогеназы, сильно ингибируется восстановленным НАДФH. Фермент высокоспецифичный к НАДФ +, константа Михаэлиса для НАД + примерно в 1000 раз выше, чем для НАДФ +.
Следующий шаг — гидролиз 6-фосфоглюконо-δ-лактона до 6 фосфоглюконат — катализируется 6-фосфоглюконолактоназою. Продукт этой реакции далее подлежит окислительной декарбоксилированию при участии фермента 6-фосфоглюконатдегидрогеназы, в результате чего образуется углекислый газ и рибулозо-5-фосфат.
Так что на этой стадии пентозофосфтаного шялху на каждую молекулу глюкозо-6-фосфата, вступает в него восстанавливаются две молекулы НАДФ +.
В некоторых тканях ПФШ заканчивается реакцией преобразования рибулозо-5-фосфата в рибозо-5-фосфата и имеет общее ривнння:
- Глюкозо-6-фосфат + 2НАДФ + H2 O → рибозо-5-фосфат + НАДФH (H +) + CO 2
Однако часто рибулозо-5-фосфат превращается в серии реакций в промежуточных продуктов гликолиза.
Неокислительный стадия ПФШ
Основан в первой стадии петозофосфатного пути рибулозо-5-фосфат дальше может подлежать действия фермента фосфопентоизмоеразы (рибулозо-5-фосфатизомеразы), что превращает его в рибозо-5-фосфат, или фосфопентоепимеразы (рибулозо-5-фосфатепимеразы), которая осуществляет реакцию образования ксилулозо -5-фосфата. Обе реакции происходят через енедиолатни промежуточные соединения.
Рибозо-5-фосфат необходим для синтеза нуклеотидов, однако, когда в клетке его производится больше чем нужно, он вместе с ксилулозо-5-фосфатом превращается в промежуточные продукты гликолиза (фруктозо-6-фосфат и глицеральдегид-3-фосфат). Преобразование трех C5 моносахаридов до двух C6 и одного C3 происходит благодаря ферментам транскетолаза и трансальдолази. Они имеют схожий механизм действия, заключается в генерировании стабилизированного карбанионы и его присоединения к электрофильного центра, такого как альдегидная группа.
Транскетолаза катализирует перенос C2 фрагмента от ксилулозо-5-фосфата в рибозо-5-фосфата, в результате чего образуется глицеральдегид-3-фосфат и седогептулозо 7-фосфат. В качестве кофактора используется тиаминпирофосфат.
Трансальдолазна реакция заключается в переносе C3 фрагмента с седогептулозо 7-фосфата на глицеральдегид-3-фосфат с образованием фруктозо-6-фосату и эритроза-4-фосфата.
Следующую реакцию снова катализирует транскетолаза, что переносит C2 фрагмент из еще одной молекулы ксилулозо-5-фосфата на эритроза-4-фосфат. Продуктами есть вторая молекула фруктозо-6-фосфата и глицеральдегид-3-фосфат.
Фруктозо-6-фосфат может снова превращаться в глюкозо-6-фосфат фосфогексозоизмеразою, глицеральдегид-3-фосфат также может использоваться для восстановления глкюкозо-6-фосфата как в глюконеогенезе. В таком случае одна молекула глюкозо-6-фосфата за 6 циклов пентозофосфатного пути полностью превращается в углекислый газ, сопровождается синтезом 12 молекул восстановленного НАДФ. Общее уравнение процесса будет выглядеть так:
- Глюкозо-6-фосфат + 12НАДФ + + 7H 2 O → 6CO 2 + 12НАДФH (H +) + Ф н.
Регуляция ЦТД.
Осуществляется с помощью дыхательного контроля.
Дыхательный контроль – это регуляция скорости переноса электронов по дыхательной цепи отношением АТФ/АДФ. Чем меньше это отношение, тем интенсивнее идет дыхание и активнее синтезируется АТФ. Если АТФ не используется, и его концентрация в клетке возрастает, то прекращается поток электронов к кислороду. Накопление АДФ увеличивает окисление субстратов и поглощение кислорода
Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ соответствует потребностям клетки в энергии. Запасов АТФ в клетке не существует
Относительные концентрации АТФ/АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой может изменяться в десятки раз.
Американский биохимик Д. Чанс предложил рассматривать 5 состояний митохондрий, при которых скорость их дыхания ограничивается определенными факторами:
1. Недостаток SH2 и АДФ – скорость дыхания очень низкая.
2. Недостаток SH2 при наличии АДФ – скорость ограничена.
3. Есть SH2 и АДФ – дыхание очень активно (лимитируется только скоростью транспорта ионов через мембрану).
4. Недостаток АДФ при наличии SH2 – дыхание тормозится (состояние дыхательного контроля).
5. Недостаток кислорода, при наличии SH2 и АДФ – состояние анаэробиоза.
Митохондрии в покоящейся клетке находятся в состоянии 4, при котором скорость дыхания определяется количеством АДФ. Во время усиленной работы могут пребывать в состоянии 3 (исчерпываются возможности дыхательной цепи) или 5 (недостаток кислорода) – гипоксии.
Ингибиторы ЦТД – это лекарственные препараты, которые блокируют перенос электронов по ЦТД. К ним относят: барбитураты (амитал), которые блокируют транспорт электронов через I комплекс дыхательной цепи, антибиотик антимицин блокирует окисление цитохрома b; монооксид углерода и цианиды ингибируют цитохромооксидазу и блокируют транспорт электронов на кислород.
Ингибиторы окислительного фосфорилирования (олигомицин) – это вещества, которые блокируют транспорт Н по протонному каналу АТФ-синтазы.
Разобщители окислительного фосфорилирования (ионофоры) – это вещества, которые подавляют окислительное фосфорилирование, не влияя при этом на процесс переноса электронов по ЦТД. Механизм действия разобщителей сводится к тому, что они являются жирорастворимыми (липофильными) веществами и обладают способностью связывать протоны и переносить их через внутреннюю мембрану митохондрий в матрикс, минуя протонный канал АТФ-синтазы. Выделяющаяся при этом энергия рассеивается в виде тепла.
Искусственные разобщители – динитрофенол, производные витамина К (дикумарол), некоторые антибиотики (валиномицин).
Естественные разобщители – продукты перекисного окисления липидов, жирные кислоты с длинной цепью, большие дозы йодсодержащих гормонов щитовидной железы, белки термогенины.
На разобщении дыхания и фосфорилирования базируется терморегуляторная функция тканевого дыхания. Митохондрии бурой жировой ткани продуцируют больше тепла, так как присутствующий в них белок термогенин разобщает окисление и фосфорилировние
Это имеет важное значение в поддержании температуры тела новорожденных
Литература
- Марри Р. и др. Биохимия человека. — М., 1993.
- Введение в биохимическую экологию. — М.: Издательство Московского университета, 1986.
- Fromm, Herbert J.; Hargrove, Mark. Essentials of Biochemistry (неопр.). — Springer, 2012. — ISBN 978-3-642-19623-2.
- Hunter, Graeme K. Vital Forces: The Discovery of the Molecular Basis of Life (англ.). — Academic Press, 2000. — ISBN 978-0-12-361811-5.
- Tropp, Burton E. Molecular Biology. — 4th. — Jones & Bartlett Learning, 2012. — ISBN 978-1-4496-0091-4.
- Collier, Leslie; Balows, Albert; Sussman, Max. Topley and Wilson’s Microbiology and Microbial Infections / Mahy, Brian and Collier, Leslie. Arnold. — ninth edition. — Virology, 1998. — Т. 1. — ISBN 0-340-66316-2.
- Северин, Е.С. Биохимия: Учеб. для вузов / Под ред. Е.С. Северина. — ГЭОТАР Медиа, 2003. — 779 с. — ISBN 5-9231-0254-4.
- Березов Т. Т., Коровкин Б. Ф. Биологическая химия: Учебник. — Медицина, 1998. — 704 с. — ISBN 5-225-02709-1.
- Николаев А. Я. Биологическая химия. — Высшая школа, 1989. — 495 с. — 50 000 экз. — ISBN 5-06-001400-2.
Глава 4. Ферменты
Понятие о ферментах
Краткая история развития учения о ферментах
Химическая природа ферментов
Строение ферментов
Активный центр ферментов
Изоферменты
Мультимолекулярные ферментные системы
Механизм действия ферментов
Кинетика ферментативных реакций
Основные свойства ферментов
Факторы, определяющие активность ферментов
- Влияние концентраций субстрата и фермента на скорость ферментативной реакции
- Активирование и ингибирование ферментов
Регуляция активности ферментов
Определение активности ферментов
Внутриклеточная локализация ферментов
Классификация и номенклатура ферментов
Список ферментов
Применение ферментов
Проблемы медицинской энзимологии
Биологическое значение и локализация
ПФШ происходит в цитозоле клеток, он несколько биологических функций. Одной из них является производство рибозо-5-фосфата, который используется для синтеза нукелотидив, которые входят в состав РНК и ДНК, а также коферментов, таких как АТФ, НАД, ФАД, кофермент А. Поэтому ПФШ активно функционирует в клетках быстро делятся: костного мозга, кожи, слизистой оболочки кишечника, а также опухолей.
Другие моносахариды, образующиеся в ПФШ также могут использоваться клетками, например, во многих микроорганизмов эритроза-4-фосфат включается в метаболические пути биосинтеза ароматических аминокислот и витамина B 6. Рибулозо-5-фосфат может превращаться в рибулозо-1,5-бисфосфат, который является акцептором углекислого газа в процессе фотосинтеза. Бактерии, растущие на среде богатом пентозы, используют пентозофосфатный путь с целью получения гексоз, например глюкозы необходимой для синтеза пептидогликана.
Во многих тканях наибольшее значение среди продуктов ПФШ имеют не моносахариды, а НАДФH, необходимого в процессах восстановительного биосинтеза и для преодоления вредного влияния активных форм кислорода. Ферменты этого метаболического пути очень распространены в тканях, где интенсивно происходит биосинтез жирных кислот (печень, молочные железы во время лактации, жировая ткань) или холестерина и других стероидов (печень, половые железы, кора надпочечников). Например, было установлено, что 30% окисления глюкозы в печени происходит пентозофосфатного пути.
ПФШ также активно протекает в клетках, которые постоянно находятся в прямом контакте с кислородом: эритроцитах и клетках роговицы и хрусталика. Здесь он нужен для поддержания восстановительного среды (высокого соотношения НАДФH / НАДФ + и восстановленный глутатион / окисленный глутатион), которое может противодействовать окислительному повреждению ненасыщенных жирных кислот (перикисного окисенню липидов), белков и других чувствительных молекул.
Разделы биохимии
-
Статическая биохимия (Биоорганическая химия) — наука о химическом составе организмов и структур составляющих их молекул (белков, аминокислот, нуклеиновых кислот, нуклеотидов, углеводов и их производных, липидов, витаминов, гормонов). Её основные объекты — биополимеры, превращения которых составляют химическую сущность биологических процессов, и биорегуляторы, которые химически регулируют обмен веществ.
- Биохимия аминокислот — наука о химическом составе аминокислот.
- Биохимия белков — наука о химическом составе белков.
- Биохимия ферментов — наука о химическом составе ферментов.
- Биохимия углеводов — наука о химическом составе углеводов.
- Биохимия нуклеиновых кислот — наука о химическом составе нуклеиновых кислот.
- Биохимия нуклеотидов — наука о химическом составе нуклеотидов.
- Биохимия липидов — наука о действии липидов, их биологических эффектах, биохимических нарушениях при недостатке или избытке в организме.
- Биохимия витаминов — наука о действии витаминов, их биологических эффектах, биохимических нарушениях при недостатке или избытке в организме.
- Биохимия гормонов — наука о действии гормонов, их биологических эффектах, биохимических нарушениях при недостатке или избытке в организме.
-
Динамическая биохимия — изучает химические реакции, представляющие обмен веществ (метаболизм), а именно пути превращения молекул и механизмы происходящих между ними реакций.
- Молекулярная биология — наука, ставящая своей задачей познание природы явлений жизнедеятельности путём изучения биологических объектов и систем на уровне, приближающемся к молекулярному, а в ряде случаев и достигающем этого предела.
- Биоэнергетика — раздел динамической биохимии, который изучает закономерности образования, аккумуляции и потребления энергии в биологических системах.
-
Функциональная биохимия — раздел биохимии, изучающий химические превращения, лежащие в основе функций органов, тканей и организма в целом.
- Биохимия микроорганизмов (Биохимия бактерий) — наука о составе и превращениях веществ в микроорганизмах.
- Биохимия растений — наука о молекулярных процессах, происходящие в растительном организме .
- Биохимия животных — наука о молекулярных процессах, протекающих в клетках живых организмов.
-
Биохимия человека — это раздел биохимии, который изучает закономерности обмена веществ в человеческом организме.
- Биохимия крови — наука о закономерностях обмена веществ в крови человека.
- Биохимия тканей — наука о закономерностях обмена веществ в тканях человека.
- Биохимия органов — наука о закономерностях обмена веществ в органах человека.
- Медицинская биохимия — это раздел биохимии, который изучает закономерности обмена веществ в человеческом организме при заболеваниях.
-
Биохимия мышечной деятельности — это раздел биохимии, который изучает закономерности обмена веществ в человеческом организме при мышечной деятельности
Биохимия спорта — наука, выявляющая закономерности обмена веществ в человеческом организме при предельной по объёму и/или интенсивности мышечной деятельности.
.
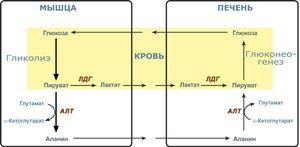
Глава 17. Кровь
Общие сведения
Химический состав крови
- Белки плазмы крови
- Характеристика основных белковых фракций
- Липопротеины плазмы крови
- Отдельные наиболее изученные и интересные в клиническом отношении белки плазмы
- Ферменты плазмы (сыворотки) крови
- Небелковые азотистые компоненты крови
- Безазотистые органические компоненты крови
- Электролитный состав плазмы крови
- Клетки крови
Буферные системы крови и кислотно-основное равновесие
- Буферные системы крови
- Нарушения кислотно-основного равновесия
- Перенос кислорода кровью
- Различные формы гипоксии
- Перенос углекислого газа кровью от тканей к легким
Система свертывания крови
- Современные представления о свертывании крови
- Факторы плазмы крови
- Факторы тромбоцитов
- «Внешний» и «внутренний» пути свертывания крови
Противосвертывающая система крови
Фибринолиз
Разница между НАДН и НАДФН
NADH: NADH — это сокращенная форма NAD.
NADPH: НАДФН является сокращенной формой НАДФ.
NADH: NAD + является окисленной формой NADH.
NADPH: НАДФ+ является окисленной формой НАДФН.
NADH: НАДН участвует в клеточном дыхании.
NADPH: НАДФН участвует в фотосинтезе.
Произведено в
NADH: НАДН производится в гликолизе и цикле Кребса.
NADPH: НАДФН образуется в результате световой реакции фотосинтеза.
Используется в
NADH: NADH используется в цепи переноса электронов для получения АТФ путем окислительного фосфорилирования.
NADPH: NADPH используется в цикле Кальвина для ассимиляции углекислого газа.
Свободная фосфатная группа
NADH: НАДН не содержат свободной фосфатной группы.
NADPH: NADPH содержит свободную фосфатную группу в положении 2 ‘рибозы, которая присоединена к адениновому фрагменту.
NADH: НАДН участвует в анаболических реакциях.
NADPH: НАДФН участвует в катаболических реакциях.
изобилие
NADH: NAD+ является наиболее распространенной формой, в то время как NADH менее распространен.
NADPH: НАДФН является наиболее распространенной формой внутри клетки.
Заключение
NADH и NADPH являются сокращенными формами NAD и NADP, соответственно. И НАДН, и НАДФН служат донорами водорода и электронов для реакций внутри клетки. NADH в основном участвует в катаболических реакциях, тогда как NADPH участвует в анаболических реакциях. NADH менее распространен в клетке, в то время как NADPH более распространен по сравнению с их окисленными формами. Основное различие между NADH и NADPH заключается в роли каждого типа восстановленного кофермента внутри клетки.
Глава 12. Обмен простых белков
Общие сведения
Динамическое состояние белков организма
Факторы, определяющие состояние белкового обмена
Нормы белка в питании
Биологическая ценность белков
Резервные белки
Парентеральное белковое питание
Переваривание белков
- Эндопептидазы
- Переваривание белков в желудке
- Переваривание белков в кишечнике
Всасывание продуктов распада белков
- Превращения аминокислот под действием микрофлоры кишечника
- Судьба всосавшихся аминокислот
- Транспорт аминокислот через клеточные мембраны
Промежуточный обмен аминокислот в тканях
- Общие пути обмена аминокислот
- Дезаминирование аминокислот
- Трансаминирование аминокислот
- Декарбоксилирование аминокислот
-
Обезвреживание аммиака в организме
Орнитиновый цикл мочевинообразования
- Специфические пути обмена некоторых аминокислот
- Обмен глицина и серина
- Обмен серосодержащих аминокислот
- Обмен фенилаланина и тирозина
- Обмен триптофана
- Обмен аминокислот с разветвленной цепью
- Обмен дикарбоновых аминокислот
Патология азотистого обмена
Классификация
| Тип НАДФH-оксидазы | Регуляторные белки и субъединицы | Механизм активации | Экспрессия в клетках (в лёгких) |
|---|---|---|---|
| NOX1 (NOH-1, MOX1) | p22phox, NOXO1, NOXA1, Rac1 | ? | эпителиальные клетки |
| NOX2 (gp91phox) | p22phox, p47phox (NOXO2), p67phox (NOXA2), p40phox, Rac1/Rac2 | Ca2+, фосфорилирование | миелоидные клетки (макрофаги, дендритные клетки), эндотелиальные клетки, гладкомышечные клетки, фибробласты |
| NOX3 | p22phox, NOXO1 | ? | эпителий вестибулярного аппарата |
| NOX4 (RENOX) | p22phox | Конститутивно активная | эндотелиальные клетки, гладкомышечные клетки, фибробласты |
| DUOX1 (Thox1, LNOX1) | DUOXA1 | Ca2+, фосфорилирование | эпителиальные клетки, лимфоциты (?) |
| DUOX2 (Thox2, LNOX2) | DUOXA2 | Ca2+, фосфорилирование | эпителиальные клетки |
Характеристика ферментов, принимающих участие в тканевом дыхании.
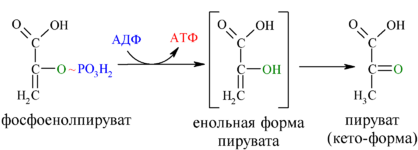
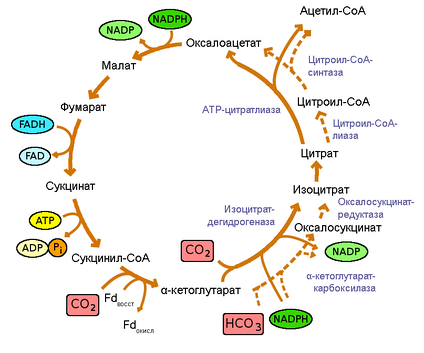
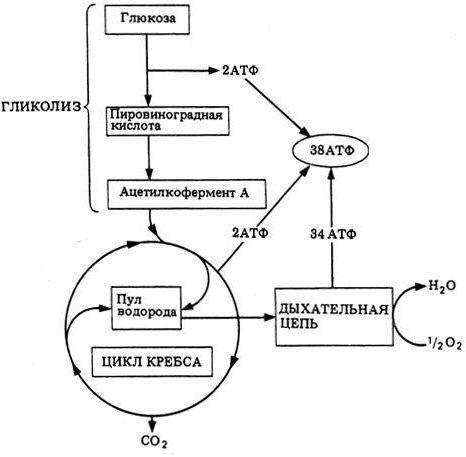
1) Пиридиновые дегидрогеназы содержат в качестве коферментов производные витамина РР (никотинамида): НАД (никотинамиддинуклеотид) и НАДФ (никотинамиддинуклеотидфосфат). Большинство электронных пар поступает в дыхательную цепь благодаря НАД– зависимым дегидрогеназам, которые катализируют реакции дегидрирования органических молекул по схеме:SH2 + НАД+ S + НАДН + Н+. В качестве органических молекул (SH2) выступают пируват, жирные кислоты, глутамат, метаболиты ЦТК: изоцитрат, α-кетоглутарат, малат и др. В данном случае ферменты относят к первичным дегидрогеназам (отнимают атомы водорода непосредственно от окисляемого вещества). В дальнейшем электроны и протоны передаются от восстановленной формы НАДН2 в дыхательную цепь на Е-ФМН (НАДН-дегидрогеназа). НАДФ-зависимые дегидрогеназы катализируют реакции по схеме: SH2 + НАДФ+ S + НАДФН + Н+. Большая часть восстановленной формы НАДФН2 образуется в пентозофосфатном цикле окисления глюкозы, локализованном в цитоплазме клетки. В дальнейшем НАДФН2 используется в процессах синтеза жирных кислот, холестерина, стероидных гормонов и др. Восстановительные эквиваленты (атомы водорода или электроны) от НАДФН2 могут поступать в дыхательную цепь, но сначала они должны быть переданы на НАД в реакции: НАДФН2 + НАД НАДФ + НАДН2.
2) Флавинзависимые дегидрогеназы. Содержат в качестве простетической группы производные витамина В2 (рибофлавина): ФМН (флавинмононуклеотид) или ФАД (флавинадениндинуклеотид). ФМН-зависимая НАДН-дегидрогеназа (Е-ФМН) является компонентом дыхательной цепи, принимает электроны от восстановленной формы НАДН2 по схеме: НАДН + Н+ +Е-ФМН НАД + Е-ФМНН2. Далее электроны от ФМНН2 поступают на кофермент-Q. Подобные ферменты называются вторичными дегидрогеназами (принимают электроны (и протоны) от первичной дегидрогеназы).ФАД-зависимые дегидрогеназы относятся к первичным дегидрогеназам, катализируют реакции окисления органических молекул по схеме: SH2 + ФАД S + ФАДН2. В качестве органических молекул (SH2) выступают жирные кислоты и янтарная кислота (метаболит ЦТК). В дальнейшем электроны и протоны передаются от восстановленной формы ФАДН2 в дыхательную цепь.
3) Железо-серные центры или Fe-S-белки ( n )(содержат негеминовое железо и атомы серы) ассоциированы с НАДН-дегидрогеназой, сукцинатдегидрогеназой и цитохромом b. Железо-серные центры участвуют в транспорте электронов за счет обратимого изменения степени окисления атомов железа .
4) Убихинон или кофермент-Q (Ко-Q) – этожирорастворимый хинон с боковой цепью из десяти пятиуглеродных изопреновых звеньев, его обозначают Q10. Убихинон выполняет коллекторную функцию, собирая восстановительные эквиваленты от НАДН-дегидрогеназы и других флавинзависимых дегидрогеназ по схеме:Е-ФМНН2 (Е-ФАДН2) + Ко-Q Е-ФМН (Е-ФАД) + Ко-QH2.
5) Цитохромы. Цитохромы принадлежат к классу гемопротеинов, молекулы которых содержат железо, входящее в состав железопорфириновой группы, или гема, напоминающего по своему строению простетическую группу гемоглобина. Существуют три класса цитохромов: a, b, c. Цитохромы являются компонентами дыхательной цепи, где располагаются в следующем порядке: b → c1 → c → aa3. Каждый из цитохромов присоединяет электрон по схеме: Fe3+ + e- Fe2+. Последним в ряду переносчиков электронов в дыхательной цепи стоит цитохромaa3, называемый также цитохромоксидазой, поскольку он переносит электроны прямо на кислород. Цитохром аа3 содержит в своем составе дополнительно два атома меди , которые участвуют в переносе электронов на кислород. Из всех переносчиков цепи переноса электронов только цитохром аа3 способен вступать непосредственно в реакцию с кислородом.